呼吸系统疾病动物模型(二)
随着大气污染、吸烟、工业经济发展导致的理化因子增多以及人口年龄老化等因素,呼吸系统疾病近年来有明显增长的趋势。
由于呼吸疾病涉及的器官较多,包括气管、支气管及肺部等,单以肺部为例,所涉疾病就包括肺阻塞、肺纤维化、肺气肿、哮喘等,下面,武汉云克隆将以大鼠/小鼠为模式动物,介绍几种常见的肺部疾病动物模型。
4.特发性肺纤维化
特发性肺纤维化(Idiopathic pulmonary fibrosis,IPF)为不明原因引起的成人慢性、进展性、纤维化性间质性肺炎。
4.1 建模方法:
SPF级C57/BL6雌性小鼠,体重约18~20g。使用气管滴注博来霉素法建模。
麻醉小鼠,仰卧固定于实验台上,颈部去毛后酒精消毒,切开皮肤,逐层暴露气管,将1mL注射器经两气管软骨环间隙朝向心端刺入气管,回抽无阻力,则注入博莱霉素 5mg/kg/L(对照组注入等量的生理盐水)。手术完毕后迅速将动物直立、旋转,使药液在肺内分布均匀,动物清醒后常规饲养。
4.2 模型鉴定及后续检测:
肺纤维化模型发展时间:给药后第 7 天肺组织大多呈重度肺泡炎改变,肺泡腔及肺间质内有大量中性粒细胞浸润,部分肺泡腔破坏或消失,肺间隔内成纤维细胞和毛细血管增生,与正常肺组织对比差别明显;给药后第14天,肺纤维化开始形成。巨噬细胞、中性粒细胞等炎性细胞明显减少,成纤维细胞增多,肺泡间隔明显增厚,有胶原沉积。给药后第28天,多数小鼠发生弥漫性肺间质纤维化,肺间质被胶原纤维和成纤维细胞替代,肺泡壁破坏,肺大泡形成,但仍可见炎性细胞浸润。



图5. 特发性肺纤维化模型小鼠(右)相对于对照组小鼠肺部组织MASSON染色对比(4周)
5.急性肺损伤模型
急性肺损伤(acute lung injury,ALI)是各种直接和间接致伤因素导致的肺泡上皮细胞及毛细血管内皮细胞损伤,造成弥漫性肺间质及肺泡水肿,导致的急性低氧性呼吸功能不全。以肺容积减少、肺顺应性降低、通气/血流比例失调为病理生理特征,临床上表现为进行性低氧血症和呼吸窘迫,肺部影像学上表现为非均一性的渗出性病变,其发展至严重阶段(氧合指数<200)被称为急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)。
5.1 急性肺损伤大鼠模型建立
SPF级SD雄性大鼠,体重约200~220g。使用脂多糖(LPS)诱导建立急性肺损伤模型。
将大鼠放入固定盒中,用酒精檫拭大鼠尾静脉后,按压住尾静脉1/3处,注射器进针后回抽有血后注入LPS溶液(溶于生理盐水,给药剂量10mg/kg),从而建立内毒素性急性肺损伤大鼠模型。对照组的大鼠尾静脉注射等体积的生理盐水。
5.2 模型鉴定及后续检测:
5.2.1 肺损伤后的目视观察:
如下图所示,在急性肺损伤模型小鼠中,肺部有多处明显渗血,后有肉眼可见肺部大面积出血渗出,可以直观的反映肺损伤程度。

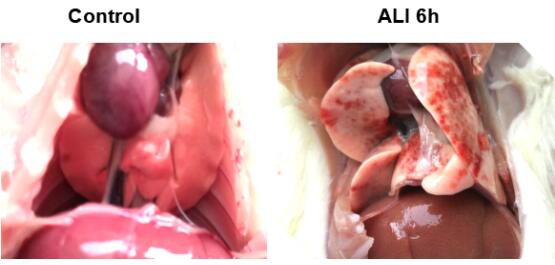
图6. 急性肺损伤模型大鼠(右)与对照组大鼠肺部照片对比
5.2.2 肺的湿/干重比检测:
肺的湿/干重比是反应肺水肿的直接指标,也是反应肺损伤严重程度的敏感指标。在急性肺损伤发生后,大量液体渗出至肺泡和肺间质,导致肺的重量增大,而肺的干重则不受影响。处死大鼠、剪断气管后取全肺,称湿重,然后将肺置于65℃恒温箱中干燥,24h 后取出称干重,计算肺湿/干重比值。

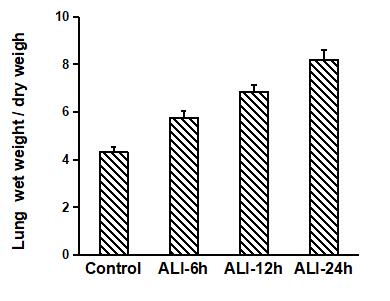
图7. 急性肺损伤模型大鼠(ALI)与对照组大鼠肺干湿重比随不同时间点的变化。
5.2.3 肺泡盥洗液(BALF)中细胞计数:
小鼠取血后,开胸,分离纵膈,注射器抽取3ml生理盐水从气管插管推入肺中,每次反复灌洗3次后抽出灌洗液,肺泡灌洗液以4℃ 3000r/min离心15min,取上清,保存于-80度用于后续检测。用 PBS冲洗沉淀物,然后用Diff-Quik染色液染色,在光学显微镜下进行细胞分类,观察计数计数中性粒细胞、巨噬细胞和淋巴细胞。
5.2.4 肺损伤后的组织病理观察 :
取左肺4%多聚甲醛固定,然后将肺组织常规脱水,石蜡包埋,切片(厚度为5μm),HE染色。HE染色肺组织学评价可以直观的反应肺损伤的程度,ALI组织病理学主要表现为肺泡中性粒细胞及红细胞的渗出,肺泡壁透明膜的形成。HE染色后可在低倍镜下观察到整个左肺组织的炎症细胞浸润、水肿以及损伤,评估肺部损伤分布情况;而高倍镜下则可以对肺泡结构进行辨认,对肺损伤程度进行评估和评分。
评分方法:取6个视野进行出血及水肿评分。
0分:没有损伤
1分:<25%的损伤面积
2分:25%~50%的损伤面积
3分:50%~75%的损伤面积
4分:>75%的损伤面积
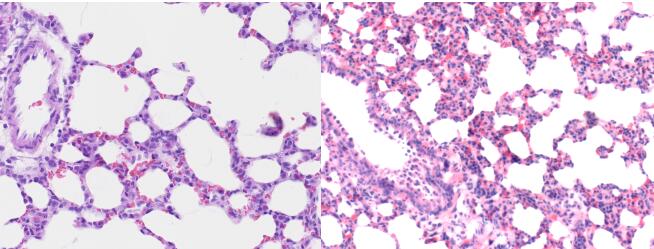
图8. 急性肺损伤模型大鼠(右图)与对照组大鼠(左图)肺组织HE染色
6.哮喘模型
哮喘又名支气管哮喘。支气管哮喘是由多种细胞及细胞组分参与的慢性气道炎症,此种炎症常伴随引起气道反应性增高,导致反复发作的喘息、气促、胸闷和/或咳嗽等症状,多在夜间和/或凌晨发生,此类症状常伴有广泛而多变的气流阻塞,可以自行或通过治疗而逆转。
6.1 哮喘小鼠模型建立
SPF级Balb/c雌性小鼠,体重约20g。采用OVA致敏诱导建立哮喘模型。
OVA致敏诱导的哮喘模型:分别于第1、8、15 天腹腔注射OVA 混悬液(含OVA 1 g /L,氢氧化铝5 g /L) 0.2 ml,实验第21 天起将小鼠置于雾化激发器内,给予2% OVA 生理盐水雾化激发,1次/d,每次30 min,连续7 天,将小鼠呼吸急促,搔鼻抓痒、呛咳烦躁、点头运动等作为哮喘小鼠模型成功的标准。正常对照组以生理盐水代替OVA腹腔注射和雾化激发,操作同上所述。
6.2 模型鉴定及后续检测:
6.2.1 小鼠支气管肺泡灌洗液(BALF) TH2型细胞因子蛋白水平检测
待造模完成后,抽取BALF后用ELISA方法检测其中TSLP、IL-33和MUC5AC的表达情况。
附支气管肺泡灌洗液抽取方法:小鼠取血后,开胸,分离纵膈,注射器抽取3ml生理盐水从气管插管推入肺中,每次反复灌洗3次后抽出灌洗液,肺泡灌洗液以4℃ 3000r/min离心15min,取上清。
结果显示:哮喘模型小鼠与对照组小鼠相比,炎性因子及趋化因子水平均有显著性升高。
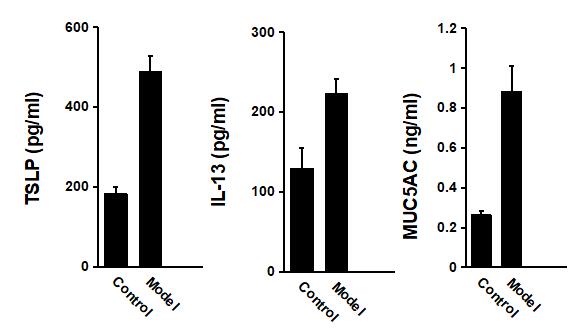
图9. 哮喘模型小鼠与对照小鼠BALF中各类细胞因子的表达水平对比
6.2.2 肺组织病理学检测
HE染色检测:待造模完成后,腹腔麻醉小鼠后,开胸暴露胸腔:取左侧肺叶固定于 10%甲醛溶液 24h,常规脱水石蜡包埋,切片行 HE 染色,光镜下观察。
结果显示:空白对照组小鼠肺泡结构清晰,肺泡大小均匀,气道黏膜上皮结构完整,纤毛排列整齐;模型对照组小鼠肺组织肺间隔增厚,支气管部分上皮细胞脱落,有淋巴细胞浸润。

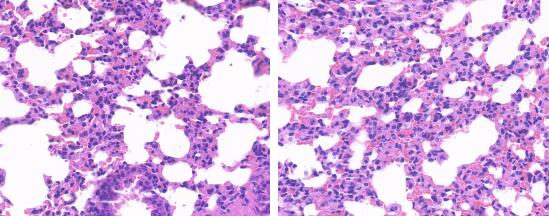
图10. 哮喘模型小鼠(右)相对于对照组小鼠肺部组织HE染色对比
阿尔辛蓝—过碘酸雪夫氏染色(AB-PAS染色)检测:待造模完成后,腹腔麻醉小鼠后,开胸暴露胸腔:取左侧肺叶固定于 10%甲醛溶液 24h,常规脱水石蜡包埋脱蜡至水,切片行 AB-PAS染色,光镜下观察。
结果显示:与对照组相比,模型组小鼠的肺组织支气管上皮杯状细胞增多。


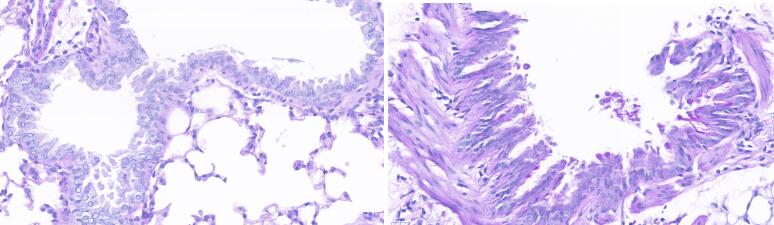
图11. 哮喘模型小鼠(右图)相对于对照组小鼠(左图)肺部组织PAS染色对比