PD-L1分子促进非小细胞肺癌细胞增殖的新机制
文献导读
2020年11月2日,苏州大学附属第一医院黄建安和刘泽毅教授及其团队在Cell Death and Difffferentiation上发表了题为“KPNB1-mediated nuclear translocation of PD-L1 promotes non-small cell lung cancer cell proliferation via the Gas6/MerTK signaling pathway”的文章。该研究揭示了PD-L1分子入核通过激活Gas6/MerTK信号通路进而促进非小细胞肺癌细胞增殖的新机制。

研究介绍
肺癌是发病率和死亡率较高的恶性肿瘤之一,严重威胁着人类的健康。传统手术、放化疗等治疗手段起效的同时,复发、转移以及副作用接踵而来,人们期待更具优势的治疗手段出现。近年来,以程序性死亡受体1(PD-1)/程序性死亡配体1(PD-L1)为靶点的免疫治疗发展迅速,已成为肿瘤治疗领域的研究热点。
PD-L1 分子是 B7 协同刺激分子超家族的重要成员,其经典作用是可以通过受体 PD-1 传递抑制性信号使肿瘤局部微环境 T 细胞免疫效应降低,介导肿瘤免疫逃逸,促进肿瘤生长。虽然 PD-L1 分子可作为肿瘤免疫治疗的有效靶点,但一部分病人并不能从该分子的免疫治疗中获益,5年生存率没有显著改善。后续研究揭示了该分子可以不依赖机体免疫系统,单独作为膜蛋白通过激活一系列肿瘤内源信号通路在多种肿瘤的增殖、转移、耐药、糖酵解等生物学过程中发挥重要调控作用。PD-L1主要表达在细胞膜和细胞浆中,但在某些特殊情况下也可以进入细胞核。研究证实核PD-L1表达与肿瘤细胞耐药及病人不良预后密切相关。因此,研究细胞核PD-L1分子在肿瘤发生发展中的功能及潜在机制已成为了当前肿瘤研究热点和难点,但在肺癌中目前尚无任何研究报道。
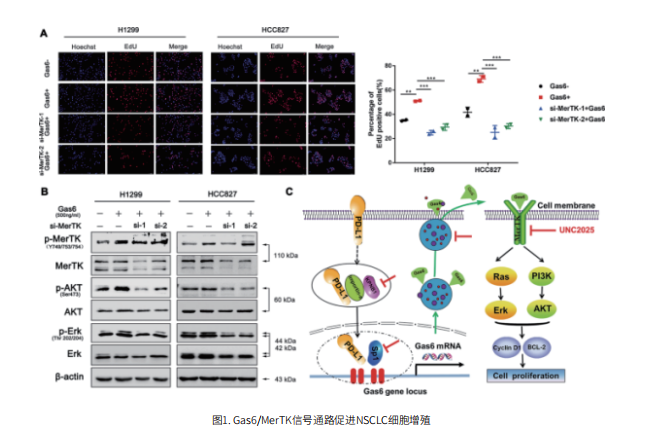
首先,作者发现干扰PD-L1表达非小细胞肺癌细胞增殖能力显著减弱。为了明确潜在机制,研究者通过蛋白芯片发现干扰PD-L1表达可降低受体络氨酸激酶家族MerTK的活化,而过表达PD-L1后MerTK活化明显增强,提示PD-L1表达可影响 MerTK信号通路的激活。蛋白质分子的亚细胞定位是蛋白发挥功能的重要体现。
之后,为了明确PD-L1如何激活肿瘤内源信号MerTK通路,作者首先证实在NSCLC细胞株中存在细胞核PD-L1的表达。接下来,作者进一步探究了PD-L1进入细胞核的分子机制。通过蛋白质质谱技术、蛋白核质分离分析发现干扰KPNB1表达后,PD-L1入核减少;而过表达KPNB1则可促进PD-L1进入细胞核,导致细胞核 PD-L1 表达增加。上述结果表明KPNB1可以协助PD-L1发生核转位过程。
作者发现MerTK活化的主要方式是通过与配体Gas6或者PROS1 结合。目前尚无研究证实PD-L1可作为单独的转录因子调控靶基因的表达。于是,作者进一步验证细胞核PD-L1是否可作为转录共活化因子通过结合其他转录因子促进Gas6的转录及表达。作者通过ChIP、双荧光素酶报告载体、野生型和突变型质粒构建等方法证实PD-L1可以与转录因子Sp1协同作用促进Gas6转录。高表达的Gas6通过粘附在外泌体表面释放至细胞外,通过与细胞膜上的MerTK受体结合,活化MerTK及其下游AKT、Erk信号通路,促进肿瘤细胞的增殖能力。该研究结果阐明了核定位的nPD-L1在NSCLC细胞增殖中的新作用,并揭示了nPD-L1介导的Gas6MerTK信号通路激活的新分子机制。同时,这一结果也为临床中针对PD-L1的免疫治疗策略提供了指导。
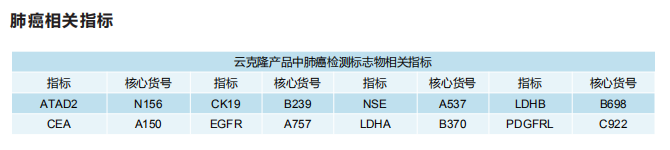
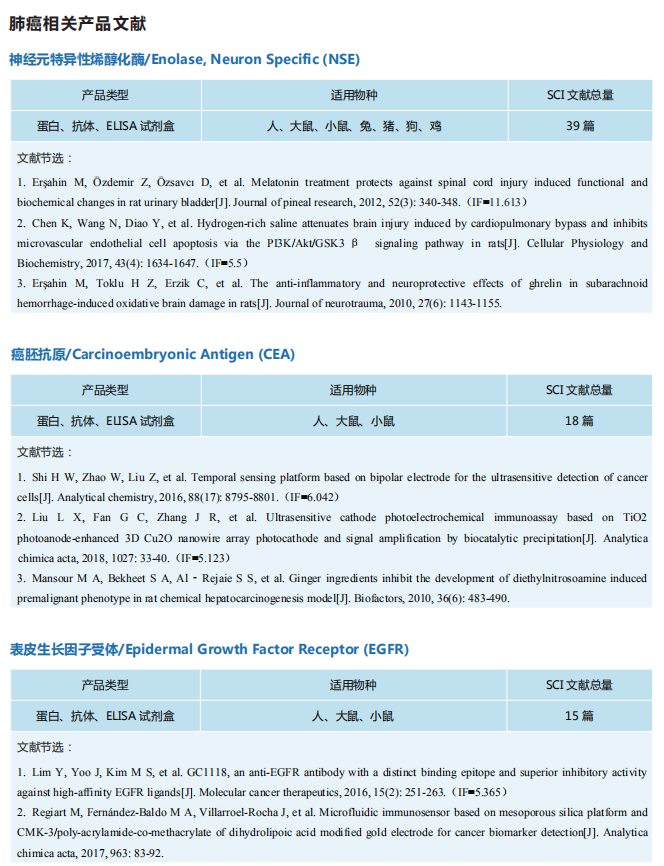
据统计显示肺癌是发病率和死亡率增长最快的恶性肿瘤之一,世界上因肿瘤致死的原因当中,肺癌位列第一位。非小细胞肺癌(NSCLC)约占已确诊的原发性肺癌总体的85%,小细胞肺癌(SCLC)约占肺癌的20%~25%。近年来,随着对肺癌研究的深入,众多与肺癌相关的肿瘤标志物被发现,在肺癌的筛选、诊断、疗效检测和预后判断等方面有着重要的临床价值。
云克隆提供肺癌相关的多种指标蛋白、抗体以及ELISA试剂盒产品,广泛的应用于人、小鼠、大鼠、猪、羊等多个物种的检测。目前客户使用云克隆肺癌相关指标产品发表的SCI文献已超过100篇。