靶向调节性T细胞免疫治疗肝癌
肝癌
肝细胞癌 (HCC) 约占原发性肝癌的 90%,是全球第四大流行癌症。在北美和欧洲,HCC 主要由丙型肝炎病毒感染、饮酒或非酒精性脂肪性肝病(NASH)发展而来;然而,在东亚和非洲,乙型肝炎病毒 (HBV) 感染是主要的病因。
调节性T细胞
调节性T细胞(Treg)是一类控制体内自身免疫反应性的T细胞亚群,是近年来免疫学领域研究的热点,其具有免疫应答低下和免疫抑制两大特征,通过“主动”的方式抑制免疫系统――发挥免疫负调作用。
Treg与NASH相关肝癌
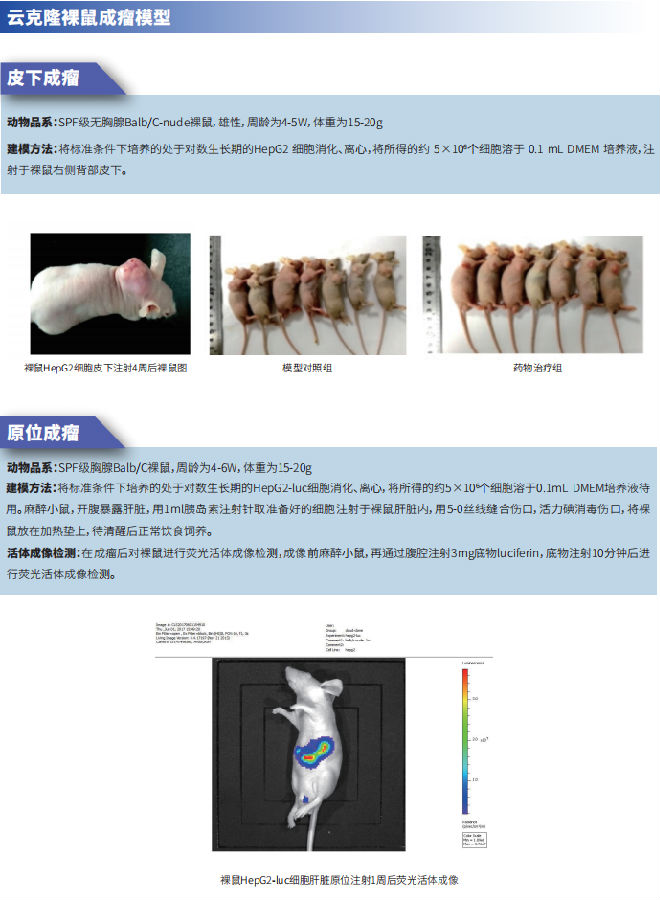
长期以来,一直观察到Treg浸润到 HCC 患者肿瘤组织中的增加,并建议将其作为潜在的预后标志物和治疗干预目标。然而,仍然缺乏对Treg在从NASH到HCC发展的癌前过程中作用的明确机制理解。2021年8月4日,美国俄亥俄州州立大学威斯纳医学中心的Allan Tsung和华中科技大学同济医学院附属同济医院的Dean Tian及团队在《Journal of Hepatology》上发表的文章揭示了这一机制(图1)[1]。在该研究中,他们发现Treg和中性粒细胞胞外陷阱(NETs)在NASH-HCC的致癌作用中起着关键作用,并证明肝内 Treg 增加有助于NASH肝脏中HCC的发生和进展。Treg受NETs调节,NETs促进线粒体OXPHOS并促进Treg从幼稚CD4+ T细胞分化。此外,幼稚CD4+ T细胞中NETs相关的代谢重编程需要toll样受体4 (TLR4)。该研究表明NETs可以通过与NASH肝脏中的Treg相互作用来将适应性免疫和先天免疫联系起来,可作为NASH-HCC的潜在治疗干预目标。同时,研究者也发现产生了几个新问题,需要进一步探索。例如,需要更多的研究来了解 NETs 结构的哪些成分与 CD4+ T 细胞上的 TLR4 相互作用,理清下游通路的性质;还需要做更多的工作来阐明 NETs 如何影响体内 Treg 抑制功能。
Treg与HBV相关肝癌
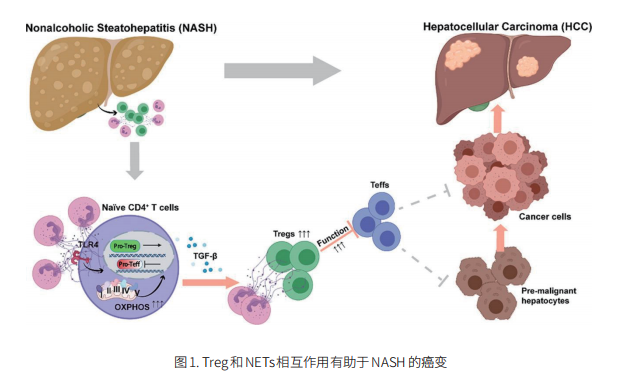
HBV感染是HCC发展的主要危险因素,通常伴随长期慢性炎症。HCC 的发病率随着病毒载量和感染持续时间的增加而增加,表明这种慢性炎症状态导致肿瘤发生的风险不断增加。 2021年9月12号,中国科学院大学生物物理研究所的Pengyuan Yang和中国人民解放军总医院第五医学中心的Fu-Sheng Wang及团队在《Journal of Hepatology》上发表的文章阐明了Treg在HBV+ HCC中的免疫抑制作用(图2)[2]。CC趋化因子受体 4 (CCR4) 在Treg和其他 T 辅助细胞上表达,与其配体CCL22和CCL17 结合,并且是介导Treg进入肿瘤微环境的关键趋化因子受体。CCR4+ Treg比CCR4-Treg具有更强的免疫抑制作用,其特点是具有PD-1+TCF1+干细胞样特性,在HBV+HCC中介导免疫抑制和免疫逃逸。此外,在体外和体内抑制 T 细胞功能方面,CCR4+ Tregs 比 CCR4- Tregs 更有效,这可能与上调 TCF1、PD-1 和 CTLA-4 水平,并分泌更多免疫抑制细胞因子(如 IL -10 和 IL-35)有关。拮抗CCR4 能克服索拉非尼耐药性,并通过特异性靶向肿瘤浸润性 Treg 以启动 T 细胞再激活,使肿瘤对检查点阻断强烈敏感。而在2021年8月4号发表在《SCIENCE TRANSLATIONAL MEDICINE》上的文章显示癌症患者 Treg 细胞上 CTLA-4 和 CD47 有着相似表达模式,CTLA-4和CD47与抗 CTLA-4×SIRPα异二聚体通过同时增强吃我信号和阻止不吃我信号来实现对肿瘤内Treg的双重靶向选择性消耗肿瘤内Treg,进而增强对实体瘤的免疫力[3]。这提示,靶向CCR4 可能是一种新的免疫治疗策略,具有广泛的应用前景,可补充抗 HCC 的一线和二线药物。
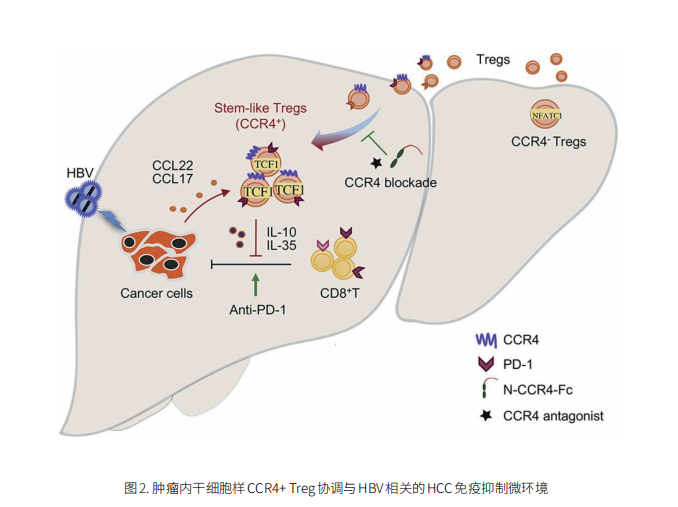
云克隆不仅可提供多种肿瘤实验动物模型,包括肿瘤移植动物模型、自发性肿瘤动物模型、诱发性肿瘤动物模型、肿瘤转移动物模型等,涵盖常见肿瘤研究。还具有各类癌症检测指标及上述Treg介导免疫抑制通路(TLR4、CCR4、CCL22、CCL17、CTLA-4 、PD-1)相关产品,可助力广大科研工作者进行癌症免疫治疗相关研究。
参考文献
[1] Wang H, Zhang H, Wang Y, et al. Regulatory T cell and neutrophil extracellular trap interaction contributes to carcinogenesis in non-alcoholic steatohepatitis[J]. Journal of Hepatology, 2021, Aug 4:S0168-8278(21)01962-0.(IF=25.083)
[2] Gao Y, You M, Fu J, et al. Intratumoral stem-like CCR4+ regulatory T cells orchestrate the immunosuppressive microenvironment in HCC associated with hepatitis B[J]. Journal of Hepatology, 2021,DOI:https://doi.org/10.1016/j.jhep.2021.08.029.(IF=25.083)
[3] Zhang A, Ren Z, Tseng KF, et al. Dual targeting of CTLA-4 and CD47 on T cells promotes immunity against solid tumors[J] .Science Translational Medicine, 2021, 13: eabg8693.(IF=17.956)