第一回:TSLP与肿瘤相爱相杀的矛盾关系
TSLP(Thymic Stromal Lymphopoietin,胸腺基质淋巴细胞生成素)是一种多效性的细胞因子,又被称为IL7样细胞因子,属IL2家族成员,可作用于多种细胞,如:T细胞、B细胞、树突状细胞、肥大细胞、嗜酸性粒细胞和肿瘤细胞等,在多种免疫反应中发挥作用。主要由初级上皮细胞释放,由某些微生物产物、物理损伤、炎性细胞因子等刺激而产生;也可通过活化的肥大细胞和树突状细胞等产生。近年来研究显示TSLP可调控肿瘤的发生发展,且根据肿瘤类型和微环境不同,作用效果也不同,甚至是发挥截然相反的作用。
TSLP发挥生物学作用主要是依赖于与受体的结合。TSLPR(TSLP受体)与TSLP亲和力很低,只有与IL7Rα(IL7受体α链)共同作用时才能形成高亲和力的受体复合物,进而形成三元复合物。这种三元复合物可引起JAK(非受体酪氨酸激酶)和STATs(信号转导和转录激活蛋白)磷酸化,从而启动炎症反应相关信号通路。TSLP与IL7的不同之处在于:IL7信号主要是通过JAK1和JAK3激活STATs,但是TSLP信号主要是通过JAK1和JAK2激活STATs。如在人和小鼠的初始CD4+ T细胞中,JAK1与IL7Rα结合,JAK2与TSLPR结合从而激活STAT5,诱导IL4、IL5、IL9、IL13的产生,进而调控Th2细胞介导的免疫反应(如图1所示)。
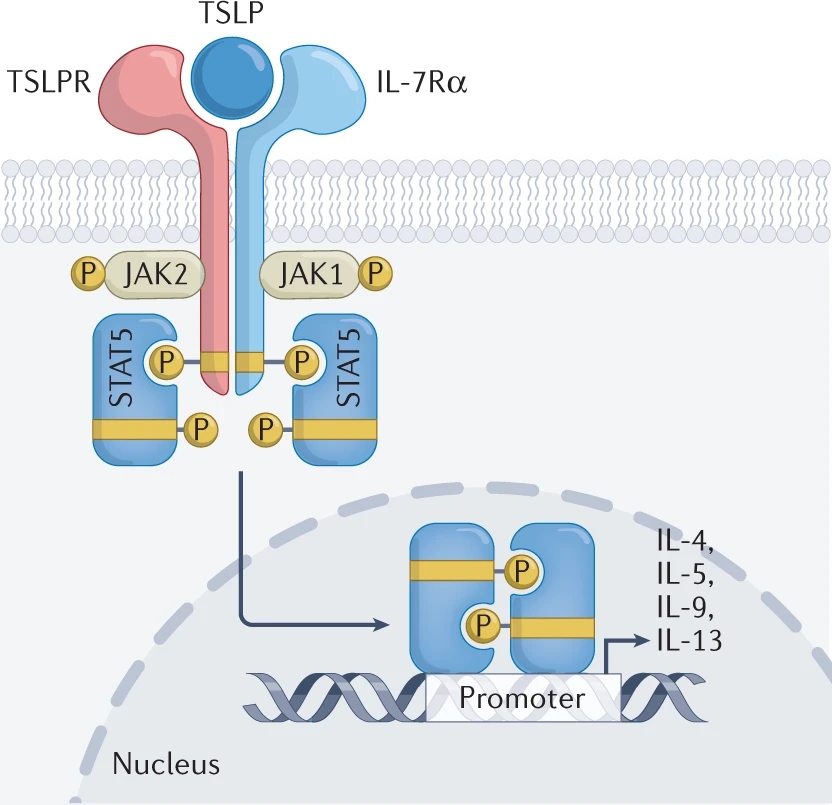
图1. TSLP信号转导机制(图片来源于《Nature Reviews Immunology》杂志)
我们先来介绍TSLP促进肿瘤的发生、发展与转移的相关研究。
某些肿瘤相关细胞产生的TSLP能促进Th2细胞极化,产生促炎细胞因子IL4、IL13和TNFa,但不产生抗炎细胞因子。这些炎性细胞因子可以诱导巨噬细胞向M2型肿瘤相关巨噬细胞(M2-TAMs)极化,Th2细胞产生的IL13和M2-TAMs分泌的EGF、TGFb可促进肿瘤的发生、发展和转移。
如人乳腺癌细胞产生的TSLP,通过上调共刺激分子如OX40L促进原位树突状细胞的成熟,树突状细胞通过OX40-OX40L相互作用促进Th1细胞向Th2细胞的分化。TSLP通过形成Th2型炎症微环境促进乳腺癌的发展,Th2细胞可分泌IL4、IL13和TNFa促进乳腺癌的原位浸润。小鼠肿瘤模型显示TSLP及OX40L中和抗体可以抑制IL13的表达从而减缓乳腺癌的发展。乳腺癌细胞分泌的TSLP还可以诱导肺组织中IL10、IL13和CCL17等免疫抑制分子产生,招募调节性T细胞,逃避免疫监视,这跟乳腺癌的肺转移可能相关。
宫颈癌细胞产生的TSLP通过下调miR-132的表达,刺激宫颈癌细胞的增殖,从而促进宫颈癌的发展。除此之外,TSLP可通过刺激宫颈癌细胞分泌CCL17,CCL17招募嗜酸性粒细胞,通过上调Ki67和BCL2导致肿瘤细胞增殖增加和凋亡减少。同时TSLP可刺激嗜酸粒细胞产生抑炎因子如IL10,增强癌细胞的免疫逃逸。TSLP还可以通过上调血管内皮细胞中CD62E的表达促进宫颈癌的侵袭和转移。
人胃癌组织可表达TSLP,但非癌胃粘膜不表达TSLP,此外,淋巴结转移、肝转移、淋巴管浸润和血管浸润也更常发生在肿瘤细胞中表达TSLP的胃癌患者中。当B16黑素瘤细胞种植在TSLPR缺乏的小鼠体内时,肿瘤的生长和转移都受到明显的抑制。角质形成细胞产生的TSLP可直接作用于皮肤T细胞淋巴瘤肿瘤细胞,或诱导Th2优势型肿瘤微环境的产生来促进肿瘤细胞的生长。
与上述研究不同,下面介绍的这些研究表明TSLP能抑制肿瘤的发生、发展和转移。TSLP可以通过直接调控CD4+ T细胞或者直接促进癌细胞的凋亡发挥其抗肿瘤效应。
如结肠癌组织与癌周正常组织相比,TSLP表达水平显著降低,且TSLP表达水平与结肠癌的临床分期评分呈负相关。外源性添加TSLP可通过CASP8(Caspase 8)依赖的外源性凋亡途径来促进结肠癌细胞的凋亡,对结肠癌细胞的增殖无影响。也有研究表明,TSLP促进结肠癌细胞的凋亡依赖TSLPR。
在Notch缺失的动物模型中,TSLP可通过直接作用于CD4+ T细胞和CD8+ T细胞的TSLPR,抑制β-catenin依赖的皮肤肿瘤的生长。此外,皮肤表皮TSLP水平的升高,可以促使皮肤形成抗肿瘤环境。正常的皮肤组织液可以通过诱导TSLP的产生而抑制肿瘤的发生。
云克隆开发了TSLP促肿瘤及抑肿瘤机制中的相关靶标产品,部分指标节选如下,希望我们研发的产品能助力TSLP及相关肿瘤的研究。
更多信息,欢迎访问:http://www.cloud-clone.cn/