黑色素瘤机制研究新发现
黑色素瘤是最致命的皮肤癌类型,起源于黑色素细胞的恶性转化。由于黑色素细胞分布相对广泛,黑色素瘤可以无处不在,并可迁移到全身,包括皮肤、葡萄膜、粘膜、内耳和直肠等。尽管在过去的几十年中,由于早期诊断、筛查方法和手术治疗的改进以及靶向治疗和免疫治疗的革命性进展,黑色素瘤患者的死亡率显著降低,但患者的预后,尤其是远处转移的患者,仍不乐观。因此,探寻黑色素瘤发生发展机制以开发新的治疗方法对改善患者预后具有重要意义。
1. 人类黑色素瘤脑转移的新见解
黑色素瘤脑转移(MBM)经常发生在晚期黑色素瘤患者中,但人们对黑色素瘤扩散到大脑的原因知之甚少。哥伦比亚大学欧文医学中心Benjamin Izar团队对22例未经治疗的MBM和10例颅外黑色素瘤转移瘤(ECM)进行了单细胞RNA-seq[1]。来自MBM的癌细胞在染色体上更加不稳定,表现出类似神经元的细胞状态,并且富含空间可变表达的代谢途径(图1)。综合空间分析揭示了推定的癌症免疫逃避的不同特征,以及MBM淋巴聚集体中更丰富的肿瘤内B到浆细胞分化的证据。MBM中含有较大比例的单核巨噬细胞和功能失调的TOX+CD8+ T细胞,这些细胞具有明显的免疫检查点表达。这项研究为MBM生物学机制提供了重要见解,确定了治疗调节的假定靶点,并为脑转移研究提供参考。
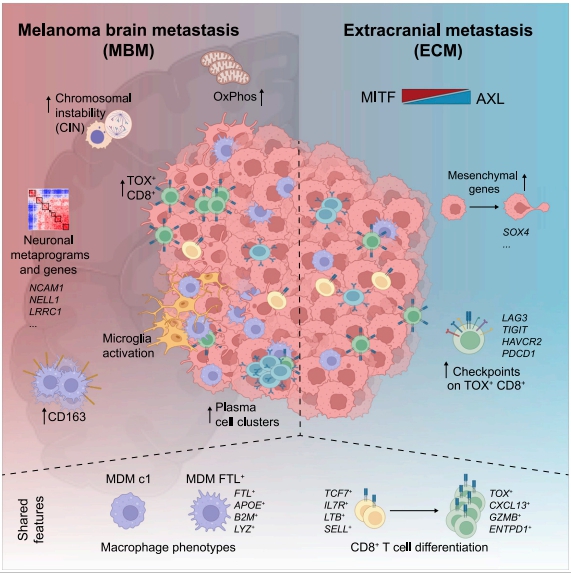
图1 多模态单细胞分析揭示未经治疗的人类MBM的基因组、转录和肿瘤微环境特征
2. 在MAPK抑制剂治疗期间通过ITCH增强PD-L1降解抑制获得性耐药
黑色素瘤的MAPK抑制剂(MAPKi)治疗导致肿瘤表面PD-L1/L2的积累,这可能逃避抗肿瘤免疫并加速获得性耐药。加州大学洛杉矶分校大卫·格芬医学院皮肤科RogerS.Lo团队发现E3连接酶ITCH结合、泛素化并下调MAPKi处理的人黑色素瘤细胞中的肿瘤表面PD-L1/L2,从而促进T细胞活化[2]。在体内MAPKi治疗期间,黑色素瘤细胞固有ITCH敲低诱导了肿瘤表面PD-L1,减少肿瘤内溶细胞性CD8+ T细胞,并小鼠中加速获得性耐药。相反,肿瘤细胞固有的ITCH过表达减少了MAPKi引发的PD-L1积累,增加瘤内溶细胞性CD8+ T细胞,并抑制获得性耐药。CD8+ T细胞耗竭和肿瘤细胞固有的PD-L1过表达使ITCH过表达的表型无效,从而支持体内ITCH-PD-L1-T细胞调节轴。这一发现为黑色素瘤新疗法的开发提供帮助。
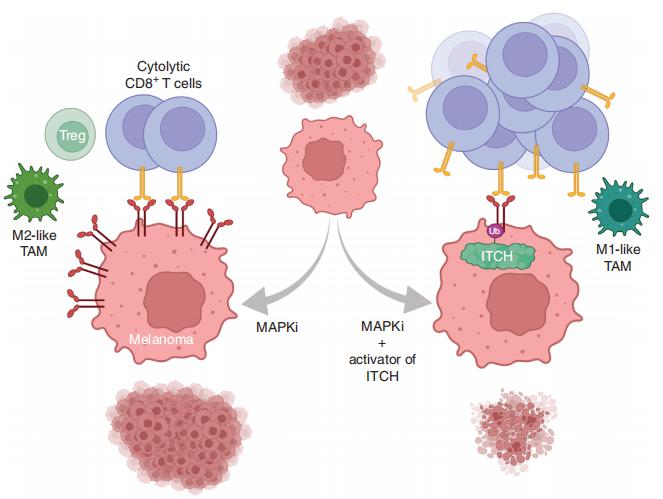
图2 ITCH增强PD-L1降解抑制获得性耐药
3. 老年肺间质变化导致黑色素瘤休眠
来自原发性肿瘤的播散性癌细胞可以在远端组织中定植,但可能需要几年时间才能形成明显的转移,这种现象被称为肿瘤休眠。美国约翰霍普金斯大学布隆伯格公共卫生学院Ashani T. Weeraratna团队发现老化的肺微环境为休眠的转移癌细胞的有效生长提供了一个宽松的生态位,与年龄相关的变化抑制了黑色素瘤的生长,但推动了癌细胞扩散[3]。他们将WNT5A鉴定为肺内黑色素瘤播散性癌细胞休眠的激活剂,使黑色素瘤细胞能够在转移性生态位中有效传播和定植。年龄诱导的肺成纤维细胞重编程增加了可溶性WNT拮抗剂sFRP1的分泌,该拮抗剂可抑制黑色素瘤细胞中的WNT5A,从而实现有效的转移性生长(图3)。他们还确定酪氨酸激酶受体AXL和MER促进黑色素瘤细胞内的休眠再激活轴。这些数据强烈表明需要将年龄视为癌症治疗设计和实施的一个参数,并作为肿瘤休眠和进展的关键调节剂。
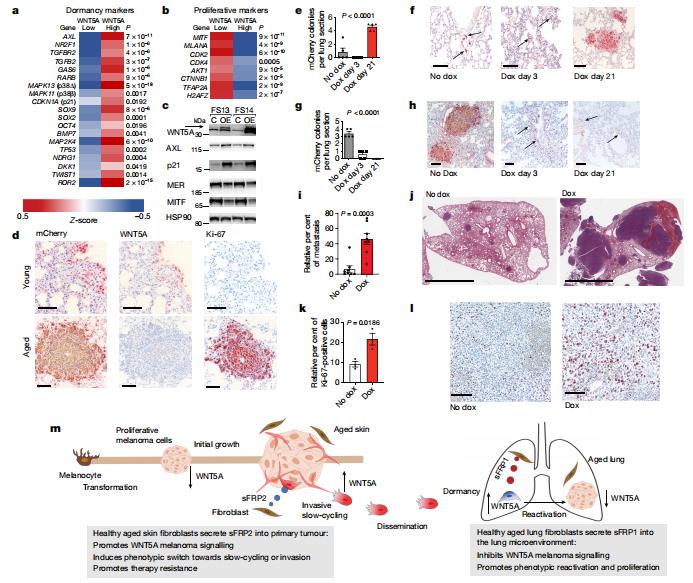
图3 WNT5A的下调促进转移性黑色素瘤在之前休眠的肺微环境中生长
4. 雄激素受体阻断促进对BRAF/MEK靶向治疗的反应
以BRAF和MEK为靶点的疗法改变了黑色素瘤和其他癌症的护理;然而,治疗耐药性很普遍,需要创新的治疗策略。美国德州大学MD安德森癌症中心肿瘤外科Jennifer A. Wargo团队研究了一组接受新辅助BRAF/MEK靶向治疗的黑色素瘤患者,观察到女性患者的主要病理缓解率和无复发生存明显高于男性患者[4]。该研究结果在其他几个接受BRAF/MEK靶向治疗的不可切除转移性黑色素瘤患者队列中得到验证,其中几个研究显示女性患者的无进展生存期和总生存期较男性患者有所改善。临床前模型研究表明,在BRAF/MEK靶向治疗后,雄性小鼠与雌性小鼠的抗肿瘤活性显著受损,与对照组相比,雄性和雌性BRAF/MEK治疗小鼠的肿瘤中雄激素受体表达显著更高。雄激素受体信号通路的药理抑制改善了雄性和雌性小鼠对BRAF/MEK靶向治疗的反应,而雄激素受体信号通路的诱导与男性和女性患者对BRAF/MEK靶向治疗的反应显著受损相关(图4)。这些结果对改善黑色素瘤BRAF/MEK靶向治疗结果具有重要意义。
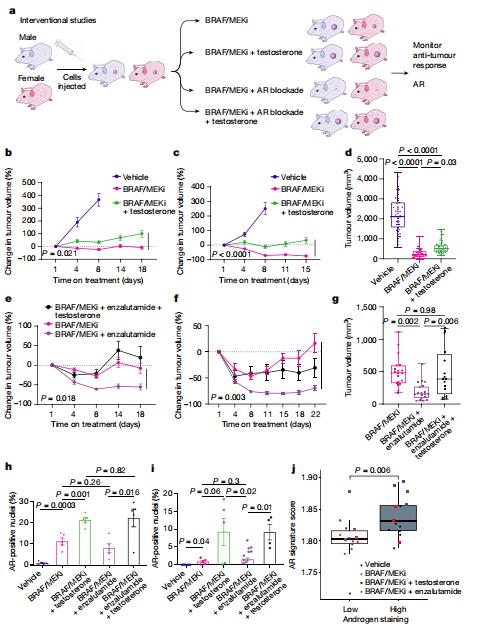
图4 雄激素受体活性的调节与BRAF/ MEK靶向治疗的差异反应相关
参考文献
[1]Biermann J, Melms JC, Amin AD, et al. Dissecting the treatment-naive ecosystem of human melanoma brain metastasis. Cell. 2022;185(14):2591-2608.e30.(IF=66.850)
[2]Yang Z, Wang Y, Liu S, et al. Enhancing PD-L1 Degradation by ITCH during MAPK Inhibitor Therapy Suppresses Acquired Resistance. Cancer Discov. 2022;12(8):1942-1959.(IF=38.272)
[3]Fane ME, Chhabra Y, Alicea GM, et al. Stromal changes in the aged lung induce an emergence from melanoma dormancy. Nature. 2022;606(7913):396-405. (IF=69.504)
[4]Vellano CP, White MG, Andrews MC, et al. Androgen receptor blockade promotes response to BRAF/MEK-targeted therapy. Nature. 2022;606(7915):797-803.(IF=69.504)
云克隆不仅可提供多种肿瘤实验动物模型,包括肿瘤移植动物模型、自发性肿瘤动物模型、诱发性肿瘤动物模型、肿瘤转移动物模型等,涵盖常见肿瘤研究。还具有各类癌症检测指标及上述MAPK、PD-L1、WNT、BRAF等相关产品,可助力广大科研工作者进行癌症相关研究。