肠道干细胞研究新发现
肠上皮是粘膜层的一部分,包含多种细胞类型,包括成熟分泌细胞、成熟吸收细胞、祖细胞/转运扩增细胞和干细胞。肠道干细胞(ISC)负责整个生命过程中持续的上皮再生。肠上皮中的干细胞到子细胞的转变被认为是一个高度动态和可塑性的过程。干细胞维持和分化为不同谱系是由周围的微环境控制,包括细胞和细胞外基质生态位。此外,在分子水平上,多种信号通路共同协调细胞间通讯以实现肠道的组织稳态,而这些级联反应的失调通常与肠道疾病有关。因此,深入了解ISC和ISC生态位可能有助于对肠道疾病机制和干细胞再生的理解。
1. 肠道菌群通过生态位肠道血清素能神经元驱动巨噬细胞依赖性ISC自我更新
Lgr5+ ISC位于隐窝底部的特殊生态位内,具有自我更新和分化能力。中国科学院生物物理研究所感染与免疫重点实验室Zusen Fan团队表明ISC由微生物群和生态位肠道血清素能神经元调节[1]。肠道菌群代谢物戊酸通过阻断NuRD复合体募集到Tph2启动子上,促进Tph2在肠道血清素能神经元中的表达。血清素反过来通过其受体HTR2A/3A激活PGE2+巨噬细胞亚群中PGE2的产生;PGE2通过与其受体EP1/EP4结合,促进ISC中的Wnt/β-catenin信号传导,从而促进其自我更新(图1)。这一研究结果说明了微生物群、肠道神经细胞、肠道免疫细胞和ISC之间的复杂串扰,揭示了生态位细胞和微生物群对ISC的新一层调控。
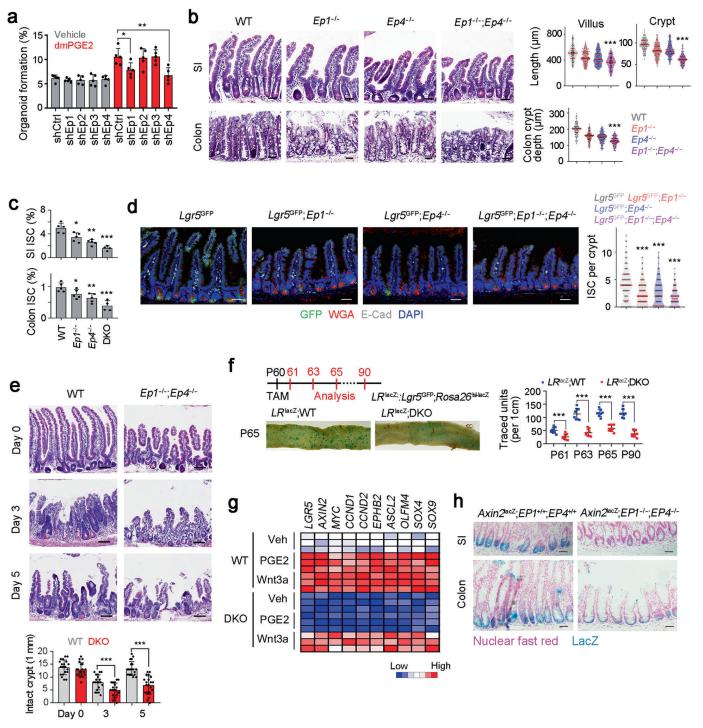
图1 PGE2驱动Wnt信号激活维持ISC的干性
2. 逆行运动决定肠道中的有效干细胞数量
肠道上皮内膜的形态和功能不同,但所有部位的组织更新都是由隐窝基部的干细胞驱动的。荷兰癌症研究所分子病理学Jacco van Rheenen团队观察到小鼠小肠隐窝含有的有效干细胞是大肠隐窝的两倍[2]。他们发现远离隐窝基部的小肠细胞由于Wnt依赖的逆行细胞运动可以作为长期有效的干细胞(图2)。相比之下,大肠中几乎没有逆行运动限制了细胞重新定位,导致有效干细胞数量减少。此外,抑制小肠逆行运动后,有效干细胞数量减少,隐窝单克隆转化率加快。这些结果表明,有效干细胞的数量是由主动逆行运动决定的,揭示了一种新的干细胞调节通道。
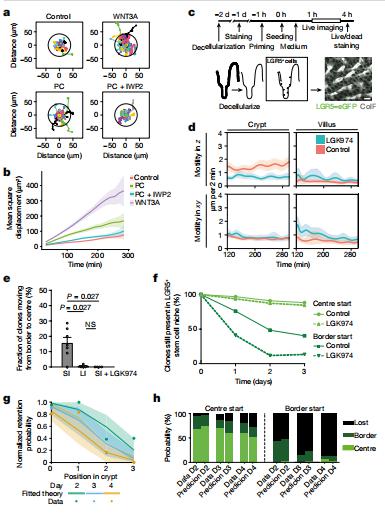
图2 Wnt信号促进LGR5+细胞迁移
3. 通过肠干细胞分化的类器官模型筛选肠上皮细胞组成的调节剂
上皮屏障的细胞组成对机体内稳态至关重要。然而,缺乏用于识别调节上皮组成和功能的生物靶标以及小分子的方法。美国哈佛-麻省理工学院健康科学与技术项目Alex K. Shalek团队展示了肠道干细胞分化的生物靶点和小分子调节剂可以通过使用数千个肠道干细胞分化成潘氏细胞的微型类器官模型进行多重表型筛选来鉴定,并通过纵向单细胞RNA测序进行验证[3]。通过该类器官模型,他们发现核输出蛋白1(XPO1)的抑制剂调节肠道干细胞的命运,显著增加类器官和野生型小鼠中潘氏细胞的丰度(图3)。这项研究提供了一个框架来构建谱系特异性分化的类器官模型,该模型可以揭示调节分化的途径以及控制屏障组织组成的化合物。
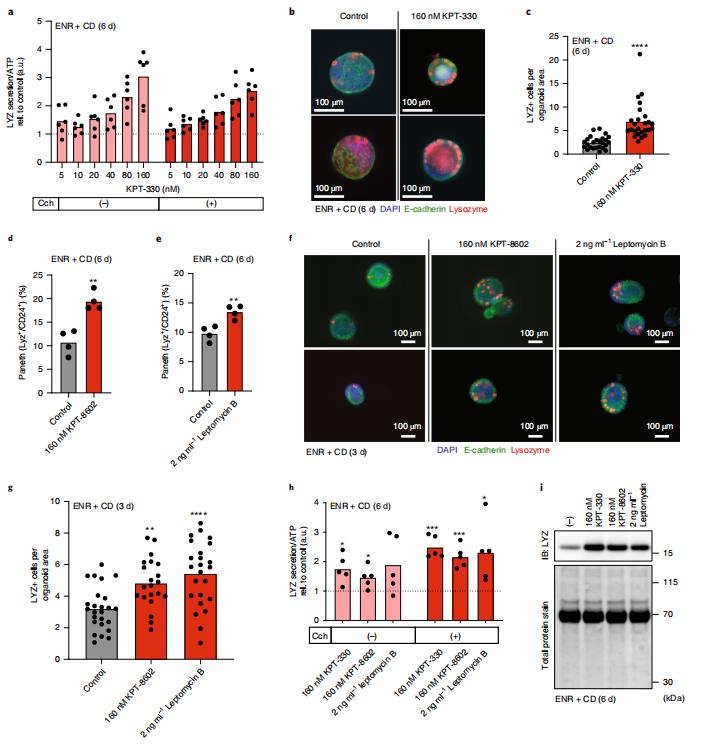
图3 XPO1抑制剂增强潘氏细胞分化
4. 淋巴管作为调节肠道干细胞活性的信号枢纽
小肠和大肠的上皮干细胞对其局部微环境作出反应,以满足对组织更新的持续需求。美国洛克菲勒大学哺乳动物细胞生物学与发育实验室Elaine Fuchs团队报告肠隐窝底部的淋巴管作为一般隐窝特别是ISC的信号枢纽发挥作用(图4)[4]。类器官共培养研究表明,淋巴衍生的配体直接作用于ISC并保持其自我更新能力和适应性,同时抑制分化。此外,他们发现Wnt信号因子(WNT2, R-SPONDIN-3)和一种迄今未被重视的细胞外基质蛋白REELIN是直接控制ISC再生潜力的隐窝淋巴信号。由于淋巴管可以发挥的作用的多样性,它们与ISC的关联可能会对疾病状态产生重要影响。因此,这一发现可能促进对肠道炎症性和代谢障碍疾病的理解。
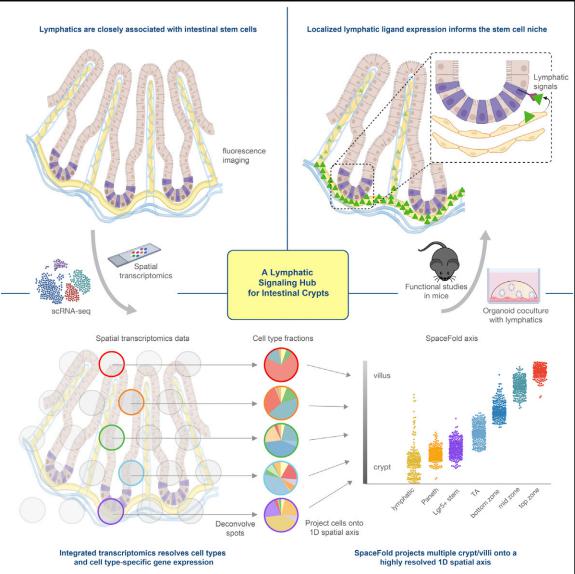
图4 淋巴管作为调节肠道干细胞活性的信号枢纽
参考文献
[1]Zhu P, Lu T, Wu J, et al. Gut microbiota drives macrophage-dependent self-renewal of intestinal stem cells via niche enteric serotonergic neurons. Cell Res. 2022;32(6):555-569. (IF=46.297)
[2]Azkanaz M, Corominas-Murtra B, Ellenbroek SIJ, et al. Retrograde movements determine effective stem cell numbers in the intestine. Nature. 2022;607(7919):548-554. (IF=69.504)
[3]Mead BE, Hattori K, Levy L, et al. Screening for modulators of the cellular composition of gut epithelia via organoid models of intestinal stem cell differentiation. Nat Biomed Eng. 2022;6(4):476-494. (IF=29.234)
[4]Niec RE, Chu T, Schernthanner M, et al. Lymphatics act as a signaling hub to regulate intestinal stem cell activity. Cell Stem Cell. 2022;29(7):1067-1082.e18. (IF=25.269)
云克隆不仅可提供多种消化系统疾病动物模型,包括胃溃疡、结肠炎、肠易激综合征、胃炎、十二指肠溃疡等常见消化疾病动物模型,还具有各类消化系统疾病检测指标和上述HTR2A/3A、PGE2、Wnt/β-catenin、XPO1等相关产品,可助力广大科研工作者进行消化系统疾病相关研究。