CAR-T细胞杀伤实体瘤需要IFNγR信号通路
CAR-T细胞疗法又名嵌合抗原受体T细胞疗法,是近年来新推出的新型精准靶向治疗肿瘤细胞技术,是一种非常有前景的新型肿瘤免疫治疗方法。CAR-T细胞疗法治疗的基本思路是从病人身上提取出免疫T细胞,然后利用基因工程技术,在体外写入能让T细胞识别特定肿瘤细胞并杀死肿瘤细胞的基因片段,这种CAR-T细胞在实验室中大量培养,之后再把扩增后的这种“加强型”免疫T细胞回输到病人体内进行治疗(如图1)。该细胞能够对肿瘤细胞特定的识别,进一步杀伤,进而达到消灭癌细胞,治疗肿瘤的目的。
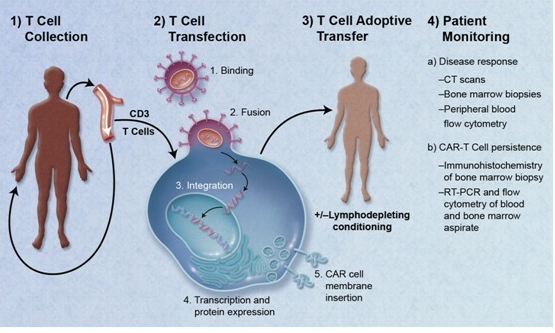
图1 CAR-T细胞疗法流程
CAR-T细胞疗法目前虽然在液体肿瘤的治疗上取得良好的效果,但在实体肿瘤的临床试验表现却不尽如人意,这背后的原因持续引发医学界的关注。近期,来自哈佛大学医学院的研究人员在《Nature》上发表了一篇题为“CAR T cell killing requires the IFNγR pathway in solid but not liquid tumours”的文章。研究人员利用CRISPR技术进行全基因组筛选,发现γ-干扰素受体(IFNγR)信号通路是 CAR-T 细胞充分粘附所必需的,实体瘤中IFNγR信号的缺失使得胶质母细胞瘤以及其他实体瘤能抵抗CAR-T细胞的杀伤。

研究人员在人U87(胶质瘤细胞系)中进行全基因组的CRISPR筛选,通过MAGeCK算法分析富集的敲除基因,寻找哪些基因的敲除使得肿瘤细胞抵抗CAR-T细胞的杀伤。本次筛选中共纳入约19000个基因,使用的CAR-T细胞靶向表皮生长因子受体(EGFR)。数据分析结果和预期一致,肿瘤细胞中靶标抗原EGFR的肿瘤细胞获得的生存优势最为明显。其次就是与IFNγR信号相关的基因缺失,如JAK2、IFNGR1和IFNGR2,也获得相当明显的CAR-T杀伤的抗性。接下来研究人员设计了IFNGR1、JAK1和JAK2单基因敲除的U87细胞以验证该通路。实验结果表明,三个U87敲除细胞系在短期和长期均对CAR-T细胞杀伤表现出相对抗性。
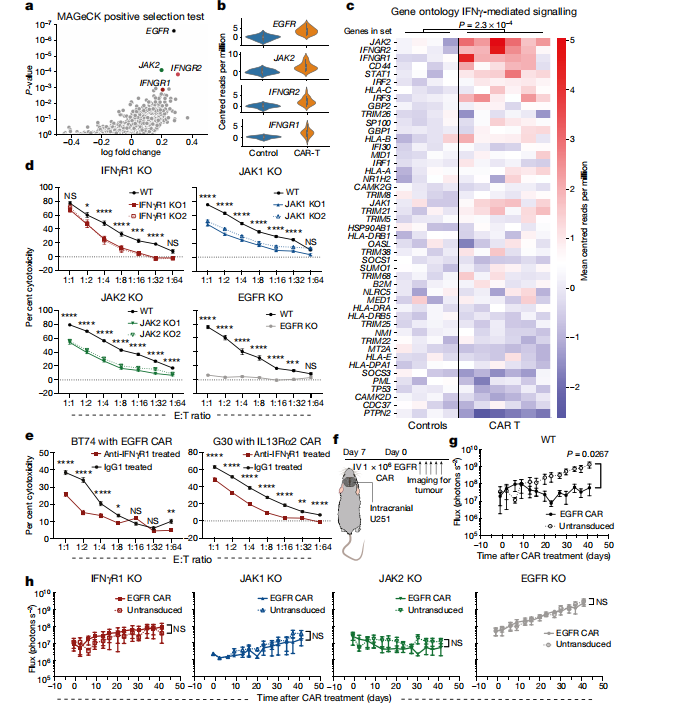
图2 IFNγR基因敲除导致实体肿瘤和液体肿瘤对CAR-T细胞毒性的敏感性不同
除了胶质瘤细胞外,研究人员还在其他实体瘤细胞上进行了类似的实验。腹腔注射IFNγR1-KO AsPC-1细胞(胰腺癌细胞系)的小鼠,经Meso-CAR-T细胞治疗后,肿瘤体积显著高于注射野生型AsPC-1的小鼠。注射Meso-KO AsPC-1细胞的小鼠14天后也表现出明显的肿瘤生长增加,生存效益降低。研究人员选取U87(人胶质细胞瘤)、SKOV-3(卵巢癌细胞)、AsPC-13三个实体瘤细胞系作为研究对象。IL13Rα2-CAR-T细胞、EGFR-CAR-T细胞、Mesothelin-CAR-T细胞分别靶向U87、SKOV-3、AsPC-1细胞。实体瘤细胞和CAR-T细胞分别采用不同的颜色进行荧光标记。U87、SKOV-3、AsPC-1分别以1:1的比例与CAR-T细胞混合孵育,每小时观测一次。与相应的野生型亲代肿瘤细胞系相比,IFNγR1-KO肿瘤细胞表现出更强的抗细胞毒性。接下来为了明确IFNγR1信号通路在液体肿瘤中的作用,研究人员使用相同的方法,腹腔注射Nalm6细胞(人急性B淋巴白血病细胞系),结果显示,IFNγR1-KO Nalm6细胞与野生型细胞表现相同,细胞动力学和细胞毒性敏感性水平较低,但缺乏CD19基因的肿瘤细胞表现出明显的肿瘤生长增加,生存效益降低。为了观察IFNγR在其他液体肿瘤的治疗作用,研究人员在Nalm6、Jeko-1(人套细胞淋巴瘤细胞)、RPMI-8226(人多发性骨髓瘤细胞)三个液体肿瘤细胞系上进行试验。IFNγR1-KO细胞与各自的野生型细胞对照相比,对CAR-T细胞毒性的敏感性没有差异。
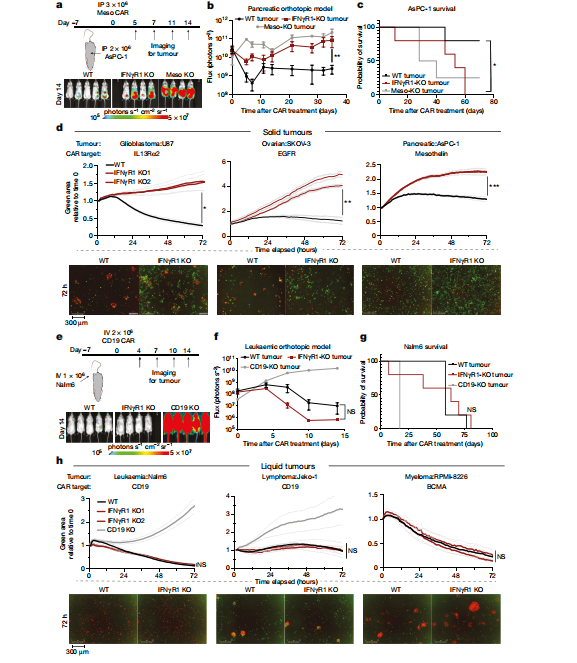
图3 固体和液体肿瘤对IFNγR1基因敲除CAR-T细胞毒性的敏感性差异
为了进一步确定IFNγR通路表现出的抗性在其他肿瘤中是否具有普遍性,研究人员将敲除不同基因的U87细胞接种至小鼠皮下,观察肿瘤细胞对CAR-T治疗的反应。结果显示,CAR-T细胞明显减缓了野生型肿瘤生长速度,而对EGFR-KO肿瘤的生长未见明显影响。研究人员分别在IFNγR1-KO和 JAK2-KO 肿瘤上观察到同样的现象。同时,研究人员还通过试验证实以上敲除对CD96+、LFA-1+和CD107a+等靶标抗原的表达不产生影响。为了探究IFNγR信号通路对液体肿瘤和实体肿瘤抗性的影响,研究人员选取U251(人神经胶质母细胞瘤)和Nalm6细胞进行实验。研究人员分别将IFNγR1-KO或EGFR/CD19-KO细胞以1:10的比例与EGFR或CD19-CAR-T共培养12h,进行转录分析,结果显示U87 IFNγR1-KO细胞显示出与EGFR-KO细胞相似的信号通路表达,而Nalm6 IFNγR1-KO细胞具有与Nalm6细胞相似的表达谱。这说明与液体肿瘤相比,实体肿瘤中的细胞对T细胞介导的细胞毒性具有不同的内在抗性机制,凋亡信号的丢失使白血病细胞对CAR -T细胞产生耐药性,该途径在实体瘤对T细胞易感性中的作用较小。
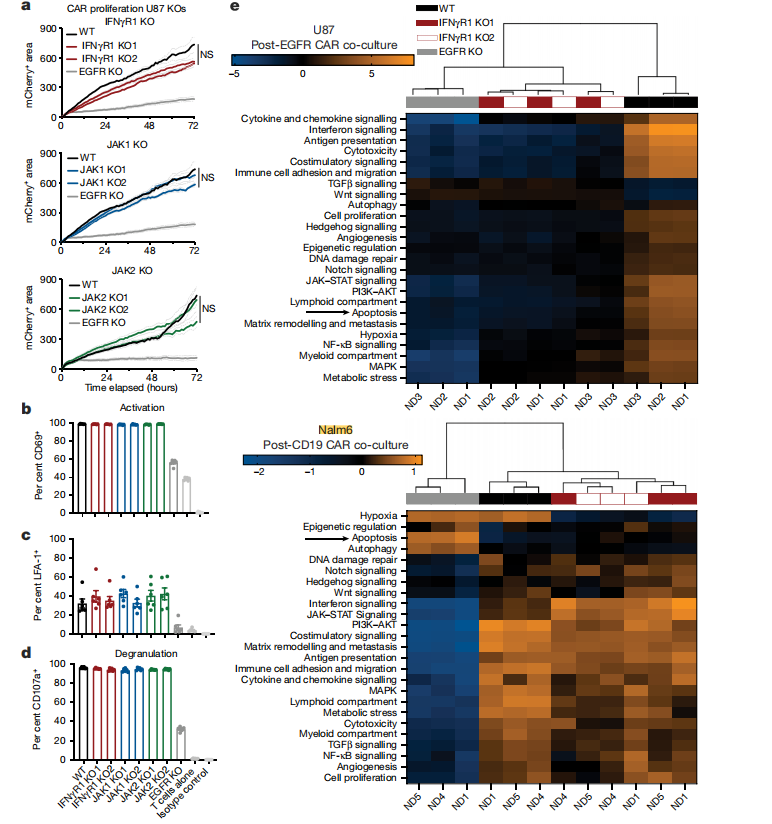
图4 CAR-T细胞和IFNγR1-KO的肿瘤细胞的共培养在肿瘤中诱导不同的转录反应
为了明确IFNγR1通路表现出的抗性是否只对靶向EGFR的CAR-T细胞有效,研究人员设计了竞争存活试验,将染色后标记的野生型U87细胞和IFNγR1-KO的U87细胞以3:1的比例混合,在CAR-T细胞的选择性压力下,IFNγR1-KO的U87细胞瘤细胞的数量增加了一倍。但在Nalm6细胞上进行相似的试验时,IFNγR1-KO Nalm6细胞并没有对野生型细胞产生同样的竞争优势。进一步研究显示,U87细胞中丢失IFNγR1会降低CAR-T细胞的结合时间。研究人员使用动态生力测量(dynamic acoustic force measurements)来测量结合亲和力,发现与野生型细胞相比,CAR-T细胞对IFNγR1-KO U87细胞的结合亲和力较低。进一步比较IFNγR1-KO的U87细胞和野生型暴露于CAR-T细胞时的基因表达差异,发现ICAM1在野生型中高表达,但在IFNγR1-KO U87细胞中表达量未见显著增加。野生型 U87细胞在暴露于EGFR-CAR-T细胞后,细胞表面和上清液中的ICAM-1基因RNA和蛋白质水平强烈上调。而在IFNγR1-KO和EGFR-KO细胞却没有观察到ICAM-1基因的显著上调。抗体介导的ICAM-1阻断能够减轻EGFR-CAR-T细胞对U87细胞的毒性,但对CD19-CAR T细胞杀伤Nalm6细胞的能力却没有显著影响。研究人员敲除了U87细胞的ICAM-1基因,与野生型细胞相比,ICAM-1-KO的U87细胞对CAR-T细胞抗性明显增强。将U87 IFNγR1-KO细胞转化为组成性表达ICAM-1,其水平与暴露于CAR-T细胞后在野生型细胞上观察到的水平相似,并发现CAR -T细胞与这些ICAM-1++细胞的结合亲和力增加。值得注意的是,所有T细胞,而不仅仅是CAR-T细胞,对ICAM-1过度表达细胞系的细胞结合亲和力增强。然而,CAR-T细胞对野生型U87细胞的结合亲和力仍显著高于EGFR-KO-ICAM-1转导的U87细胞。此外,当ICAM-1在IFNγR1-KO细胞系上过度表达时,EGFR-CAR-T细胞的细胞毒性更强,但不会使CAR-T细胞的细胞毒性独立于抗原,因为EGFR-KO细胞上的ICAM-1过度表达不会增加细胞溶解。
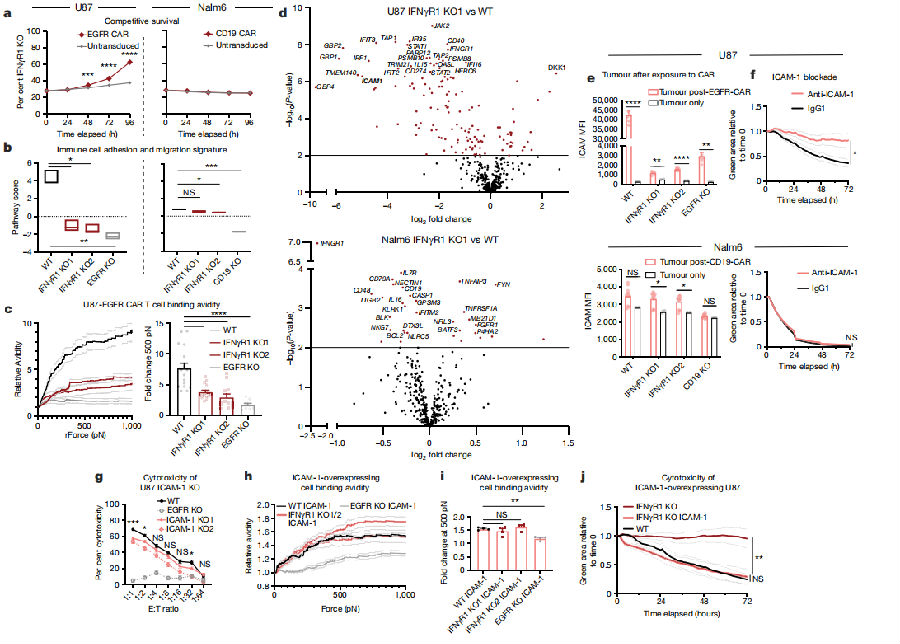 图5 IFNγR1信号上调ICAM-1并使CAR-T细胞毒性增强
图5 IFNγR1信号上调ICAM-1并使CAR-T细胞毒性增强
综上所述, 液体肿瘤和实体肿瘤与CAR-T细胞的相互作用的途径不同,加强T细胞和肿瘤细胞之间的结合相互作用可能会对实体肿瘤的治疗中产生更好的效果。另外,在液体肿瘤中抑制干扰素γ可能在保持疗效的同时还能降低它的毒副作用。
云克隆公司提供上述研究中涉及相关指标的蛋白、抗体、ELISA试剂盒等产品,助力相关研究:
![OU128VV1HPRH{~}O3SYO]$M.png](http://static.cloud-clone.cn/topic/cn/636c6f24a96fe.png)