溶酶体的修复机制
溶酶体是哺乳动物细胞的中央裂解细胞器,负责降解多种生物大分子。这些大分子通过内吞、吞噬或自噬途径到达溶酶体,在溶酶体腔中被60多种酸性水解酶降解,随后被细胞的代谢过程重新利用。近年来的研究表明溶酶体除了降解作用外还参与许多其他细胞过程,包括:代谢信号、基因调节、免疫、质膜修复、细胞粘附和迁移,在细胞衰老、人类疾病中扮演着至关重要的角色。溶酶体异常会导致一系列的疾病,因此研究溶酶体的相关作用机制对于疾病的治疗十分重要。
溶酶体破裂会导致内容物(包括组织蛋白酶)从溶酶体腔渗漏到细胞质中,可能导致细胞凋亡或坏死。之前的研究普遍认为,细胞中存在两种潜在的溶酶体修复机制——溶酶体自噬(lysophagy)介导的间接修复,以及内体分选复合物(ESCRT)介导的直接膜孔修复。
溶酶体自噬:损伤诱导的mTORC1从受损溶酶体解离。mTORC1的解离导致TFEB的去磷酸化,并将其转移到细胞核,从而诱导溶酶体和自噬基因的转录。泛素被募集到受损溶酶体中,可像其他选择性自噬一样参与受损溶酶体的识别。自噬体会选择性地隔离受损的溶酶体。含有受损溶酶体的自噬体可以与其他的完整溶酶体融合,形成新的具有低pH值和降解能力的溶酶体。
ESCRT介导的直接膜孔修复:溶酶体膜结构损伤会激活ESCRT的运输组分ALIX的脂质结合活性,而ALIX又招募ESCRT-III到破裂的膜中。ESCRT-III复合物的独特特征是在膜表面形成丝状螺旋,这些螺旋会收缩以封闭脂质双层中的孔。在这些“低损伤”条件下,许多溶酶体被修复、再酸化,然后用组织蛋白酶补充。此外,热休克蛋白-70(Hsp70)可以通过加强酸性鞘磷脂酶(ASM)与膜的相互作用来稳定膜。
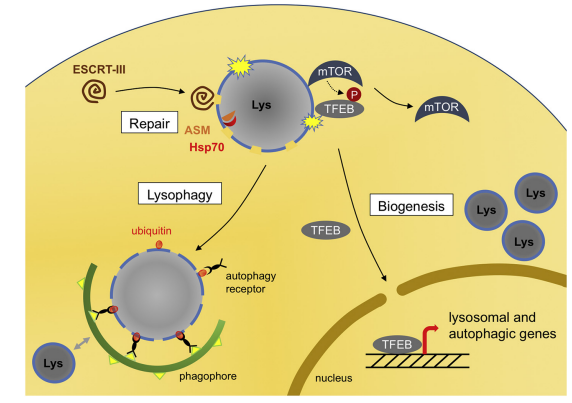
图1 受损溶酶体的自噬清除和ESCRT介导的直接膜孔修复
(图片来自 《Journal of Molecular Biology》)
具有严重溶酶体膜透化(LMP)的溶酶体被溶酶体自噬选择性降解,而较温和的LMP可以通过ESCRT更快、直接修复。但是,ESCRT亚基的耗竭仅导致快速溶酶体修复的部分缺陷,表明存在额外的修复机制。近期一份研究成果表明还存在第三种修复机制-磷脂肌醇启动的膜系结和脂质运输(PITT途径)。
当溶酶体膜受损时,磷脂酰肌醇-4激酶2α型(PI4K2A)会在受损的溶酶体膜上迅速积累,产生高水平的脂质信使磷脂酰肌醇-4-磷酸(PI4P)。溶酶体磷脂酰肌醇-4-磷酸反过来招募多个氧化甾醇结合蛋白(OSBP)相关蛋白(ORP)家族成员,包括:ORP9、ORP10、ORP11和OSBP,这些蛋白质将内质网与溶酶体连接起来。然后这些ORPs将PI4P与来自内质网的脂质交换,包括磷脂酰丝氨酸。磷脂酰丝氨酸会募集脂质转运体ATG2。ATG2活性也受到磷脂酰丝氨酸的有效刺激,通过大规模脂质运输直接修复溶酶体漏洞。
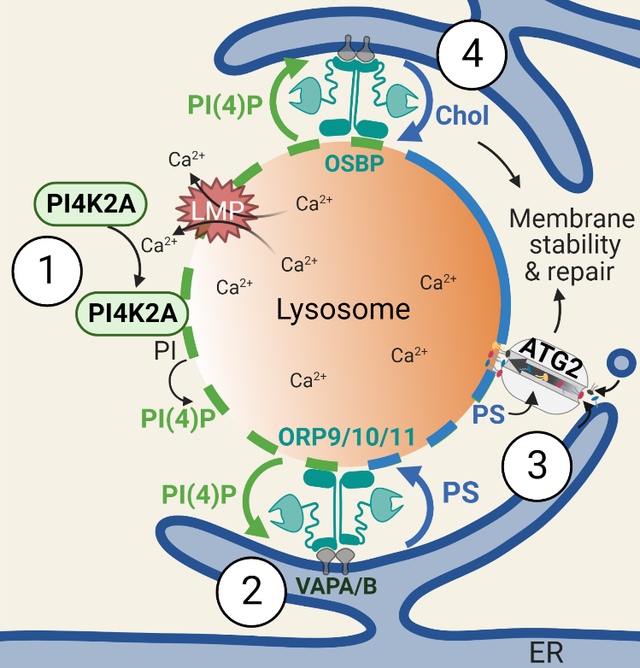
图2 PITT途径介导溶酶体快速修复
(图片来自《Nature》)
PITT途径是快速修复溶酶体的主要和必要途径。PITT途径可以被多种疾病相关的溶酶体损伤所激活,如,PITT途径的缺失会加剧tau纤维的扩散 ,这是阿尔茨海默病进展的关键步骤;缺乏PITT途径也会增加细胞中脂褐质(lipofuscin)的积累,脂褐质是衰老溶酶体的病理特征,也是已知的衰老标志。在小鼠模型和人类患者中,缺失PITT通路的第一个关键酶PI4K2A会导致严重的神经退行性变和早衰。
PITT途径的发现是理解和治疗与溶酶体功能障碍相关的衰老和疾病的重要一步。对动脉粥样硬化、神经退行性疾病、胰腺炎、自身免疫性疾病、溶酶体贮积症和癌症等疾病中的溶酶体相关机制研究有助于开发靶向溶酶体的新疗法。
云克隆开发了上述研究中涉及到的相关靶标产品,靶标及核心货号如下,供参考:
