细胞死亡与癌症(一)
细胞死亡是维持生物发育和内部环境稳态的生理过程。细胞死亡可根据是否受到基因调节而分为被动和程序化过程。如图1,细胞死亡分为被动细胞坏死(Necrosis)和程序性细胞死亡(Programmed Cell Death),程序性细胞死亡分为细胞凋亡(Apoptosis)和程序性细胞坏死(Programmed Necrosis)。程序性坏死在细胞中广泛存在,它是细胞死亡的一个重要类别,是一个大家族,包括坏死性凋亡(Necroptosis)、细胞焦亡(Pyroptosis)、铁死亡(Ferroptosis)和其他不常见且机制不明的程序性细胞坏死。在之前的推文中介绍过这些细胞死亡方式,在这里,我们将介绍Necrosis、Apoptosis以及Necroptosis与癌症的关系。
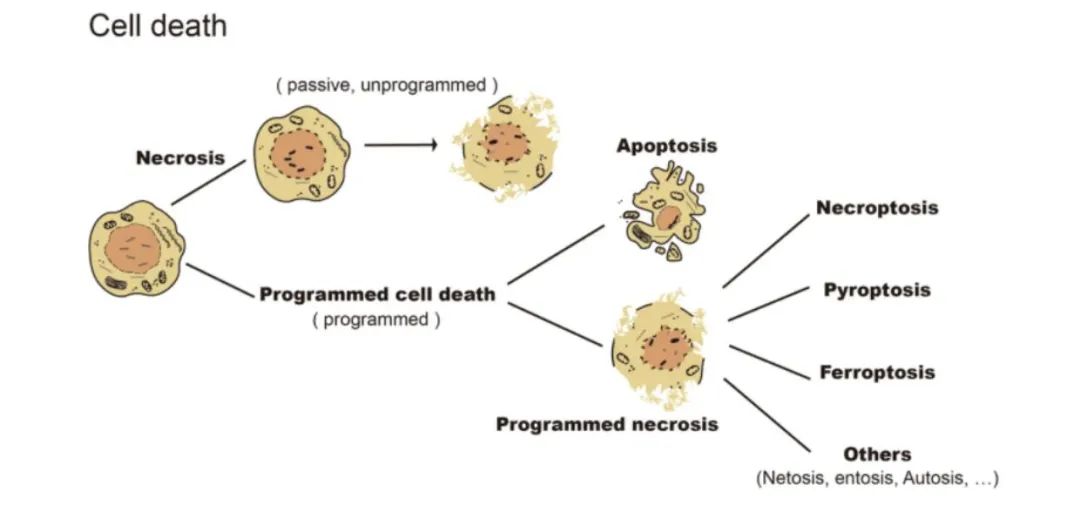
图1. 细胞死亡方式(图片来源于《Nature》杂志)
细胞坏死(Necrosis)
Necrosis是细胞死亡的一种被动形式,不受任何分子途径相关蛋白的调节,仅受物理和化学因素的影响,如渗透压改变、高温、高压、缺氧、冷冻和机械剪切力。其特征是细胞膜破裂和细胞内容物释放导致炎症反应。坏死细胞通过释放损伤相关的分子模式(damage associated molecular patterns,DAMPs)促进炎症反应。DAMPs启动免疫应答,清除免疫原性肿瘤细胞,而发挥保护功能,在初始阶段有效抑制肿瘤生长。另外,DAMPs的释放也可能引发慢性炎症,从而促进肿瘤的发展。一方面从机制上讲,炎症是肿瘤生长的一个重要驱动因素,可通过多种机制发生恶性转化,包括:1)炎症相关活性氧(ROS)和活性氮中间体(RNI)引起的遗传损伤;2)通过细胞因子诱导的生长因子促进增殖;3)通过激活抗凋亡细胞死亡途径(如NF-κB)来抵抗细胞死亡。
另一方面,越来越多的证据表明DAMPs也发挥免疫抑制作用,最终促进肿瘤的发展。如图2,细胞坏死释放的DAMPs(如:Uric acid、HMGB1、S100、IL-1α和Adenosine等)可通过不同的机制和靶细胞促进肿瘤进展,HMGB1和Adenosine参与免疫抑制,HMGB1和IL-1α参与血管生成,Uric acid、HMGB1、S100和Adenosine促进肿瘤细胞增殖。介于DAMPs在免疫系统对肿瘤的反应中的关键作用,DAMPs信号通路的进一步研究可为抗肿瘤治疗开辟了新的可能性。

图2. DAMPs介导肿瘤进展(图片来源于《Oncogene》杂志)
细胞凋亡(Apoptosis)
细胞凋亡(apoptosis)是由基因控制的细胞自主的有序的死亡,是一种主动的细胞死亡方式。细胞凋亡在胚胎发育和整个生命周期中发挥着不可替代的作用。过度的细胞凋亡可能会导致退行性疾病,如阿尔茨海默病和其他神经退行性疾病;而细胞凋亡不足是许多癌细胞的特征。一些癌细胞能逃避内源性DNA损伤和外源性T细胞杀伤引起的凋亡。癌细胞还能表达配体,如程序性死亡配体1(PD-L1),以抑制T细胞的功能并实现免疫逃逸。Rebecca等总结了癌细胞逃避凋亡的五种方式(图3):1)癌细胞中死亡受体(如:TNFR1、FasL等)表达降低;2)抗凋亡的蛋白(如:Bcl-2、Bcl-XL等)高表达以及促凋亡蛋白(如:Bax、Bak等)表达不足;3)凋亡抑制相关的蛋白(如:IAPs)过表达;4)胱天蛋白酶(Caspases)表达降低;5)p53突变的表达降低。
了解癌细胞中的这些抗凋亡机制,有可能找到促进凋亡和治疗癌症的相应药物。化疗药物(如:顺铂)通过旁路死亡受体、Bcl-2抑制剂和IAPs抑制剂促进细胞凋亡,能有效地增加了癌细胞的凋亡水平。另外使用药物激活胱天蛋白酶和绕过p53有助于促进癌细胞凋亡。可见,细胞凋亡的研究对于癌症的治疗非常重要。
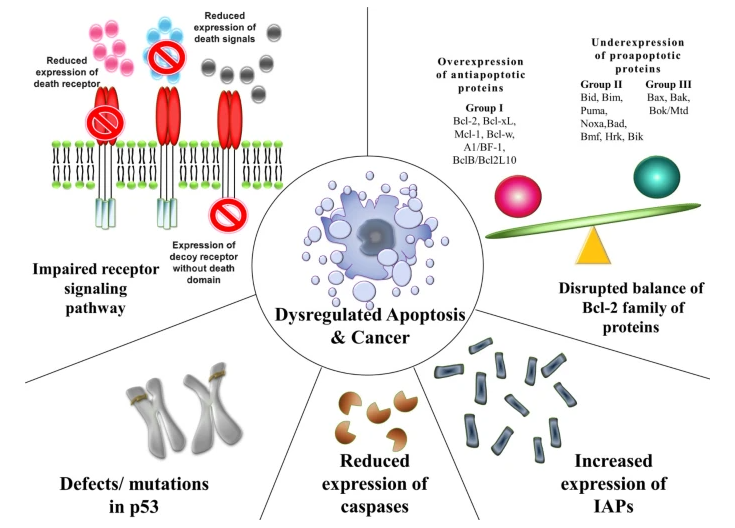
图3. 癌细胞逃避凋亡的五种方式(图片来源于《J EXP CLIN CANC RES》杂志)
坏死性凋亡(Necroptosis)
坏死性凋亡是不同于细胞坏死和细胞凋亡的另一种死亡模式,是一种受控的细胞坏死途径,由受体相互作用的丝氨酸/苏氨酸激酶蛋白(RIPK1、RIPK3)介导,通过其激酶功能驱动的调节性细胞死亡模式形成复合物IIB,从而导致细胞坏死。它具有坏死细胞的形态学特征和类似于凋亡细胞的信号机制。形态学上,其特征是细胞膜穿孔,细胞内渗透压增加,导致细胞呈圆形和肿胀,细胞器肿胀,线粒体功能障碍,线粒体膜电位丧失,核染色质丧失,质膜爆炸性破裂。细胞破裂后释放的内容物加剧了外周炎症反应。
近年来,坏死性凋亡与癌症关联的研究多是围绕促坏死分子(RIPK3、MLKL等)的基因表达及其对人类癌症患者生存和抗癌治疗反应性的单变量或多变量影响。表1中总结了各种主要临床研究中RIPK3等促坏死分子对癌症患者预后/预测影响。虽然多项研究发现,全肿瘤活检水平RIPK3的高表达以及有时MLKL的高表达可能会预测癌症患者的生存期延长,但RIPK1或MLKL的高表达也被证明可以预测某些癌症患者的预后更差。对74例接受5-氟尿嘧啶(5-FU)化疗的原发性结直肠癌(CRC)患者肿瘤中RIPK3表达的分析表明,RIPK3的高表达水平与CRC患者的总体生存期显著延长和疾病进展风险降低相关。与此一致,RIPK1的低表达与头颈部鳞状细胞癌(HNSCC)患者的肿瘤进展更高和人肝细胞癌(HCC)患者的预后更差相关。与此相反,RIPK1的高表达也与黑色素瘤的预后更差和转移率更高有关,这可能是由于NF-κB依赖性刺激癌细胞增殖。MLKL基因表达也呈现双重预后作用。如在乳腺肿瘤中,MLKL的高表达与预后不良相关,但在CRC中低MLKL表达预测患者的总生存期较短。事实上,多项研究表明,促坏死基因(通过基因敲除或敲除模型测试)和/或凋亡性坏死具有促肿瘤或抗肿瘤作用。
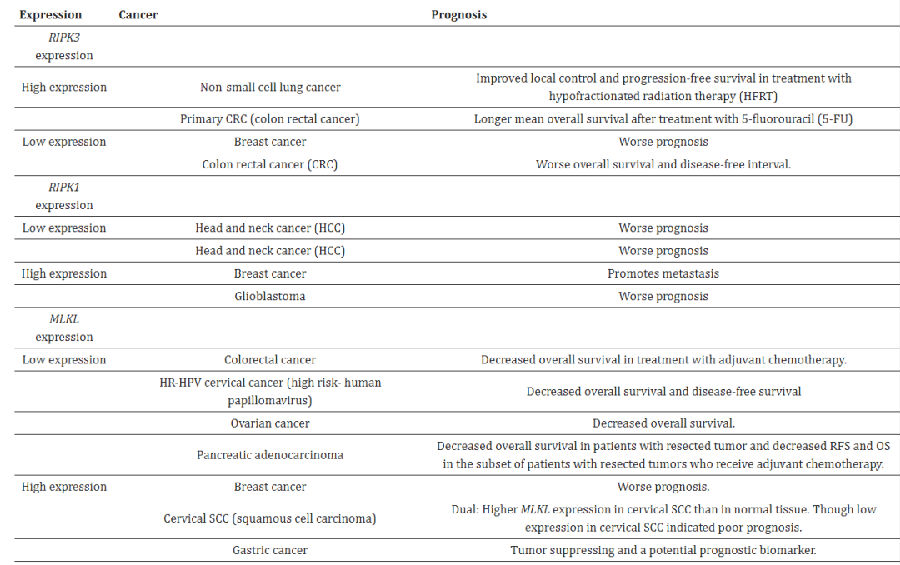 表1. 促坏死分子对癌症患者预后/预测影响(来源于《Cells》杂志)
表1. 促坏死分子对癌症患者预后/预测影响(来源于《Cells》杂志)
云克隆开发的相关靶标产品助力细胞死亡与癌症关联研究,部分指标节选如下:
指标 | 核心货号 | 指标 | 核心货号 | 指标 | 核心货号 |
HMGB1 | IL-1α | IL1R1 | |||
Uric acid | TLR2 | ATP | |||
| TLR4 | TLR9 | RAGE | |||
| S100A8/A9 | S100A4 | S100A12 | |||
S100A8 | S100A9 | S100B | |||
TIM3 | NK-κB | PD-L1 | |||
| FasL | Bcl-2 | TNFR1 | |||
| MCL-1 | BCL-W | Bcl-XL | |||
Puma | Bid | A/BF-1 | |||
Bmf | Hrf | Bim | |||
| Bax | Bak | Bad | C337 | ||
p53 | RIPK1 | RIPK3 | |||
| MLKL | NAIP | c-IAP1 | |||
c-IAP2 | XIAP | Survivin | |||
| BRUCE | Livin | Caspase 1 | |||
| Caspase 2 | Caspase 3 | Caspase 4 | |||
| Caspase 5 | Caspase 6 | Caspase 7 | |||
| Caspase 8 | Caspase 9 | Caspase 10 | B161 | ||
Caspase 12 | Caspase 13 | Caspase 14 |