细胞死亡与癌症(二)——细胞焦亡及铁死亡与癌症的关联
细胞死亡是维持机体内环境稳态的一种基本生理机制,当细胞死亡调控机制紊乱,则会引起疾病的发生。细胞死亡可作为治疗各种癌症、神经退行性疾病以及自生免疫性疾病的重要切入点。在之前的专题——细胞死亡与癌症(一)中,介绍了细胞坏死,细胞凋亡以及坏死性凋亡与癌症的关联。本期专题,我们将介绍细胞焦亡及铁死亡与癌症的关联。
细胞焦亡(Pyroptosis)
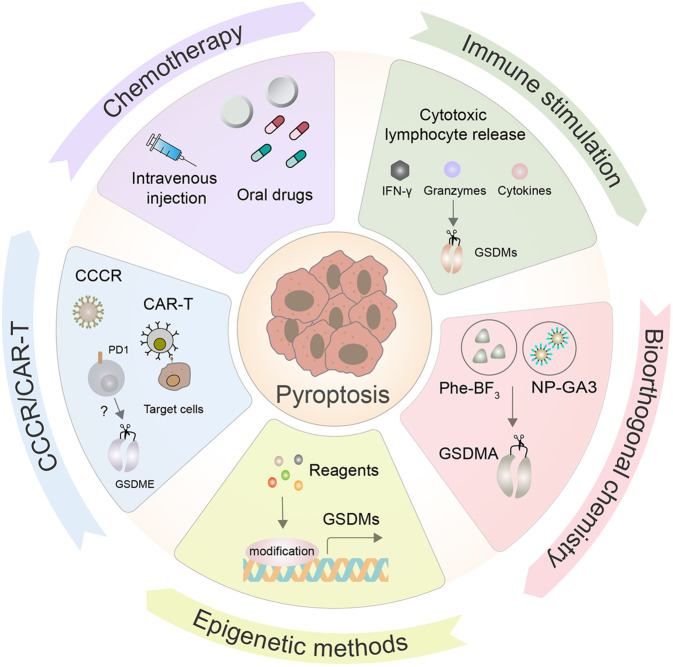
图1. 细胞焦亡在抗癌治疗中的前景
(图片来源于《Cell Mol Immunol》)
铁死亡(Ferroptosis)
研究发现,铁死亡在抗肿瘤免疫中具有双面性。CD8+细胞毒性T细胞可分泌干扰素-γ(IFNγ),进而抑制SLC7A11在癌症细胞中的表达,增强抗肿瘤免疫,从而促进肿瘤细胞脂质过氧化和铁死亡。此外,嗜铁性肿瘤细胞可释放多种免疫刺激信号,促进树突状细胞成熟,提高巨噬细胞,尤其是M1样肿瘤相关巨噬细胞,吞噬嗜铁性肿瘤细胞的效率,这进一步加强了CD8+细胞毒性T细胞介导的肿瘤抑制。对于免疫抑制细胞,包括:调节性T(Treg)细胞、髓系衍生抑制细胞(MDSCs)和M2样肿瘤相关巨噬细胞,通过诱导铁死亡也可以增强抗肿瘤免疫。谷胱甘肽过氧化物酶4(GPX4)的Treg特异性缺失可诱导调节性T(Treg)细胞铁死亡。而靶向N-酰基鞘氨醇酰胺水解酶2(ASAH2)可诱导MDSCs铁死亡,并促进CD8+细胞毒性T细胞的激活,从而增强抗肿瘤免疫。然而,CD8+T细胞和一些T辅助细胞亚群,如T滤泡辅助细胞(TFH),对于铁死亡高度敏感。这类细胞被诱导发生铁死亡导致抗肿瘤免疫效应受到抑制,进而对肿瘤的发生起到促进作用。
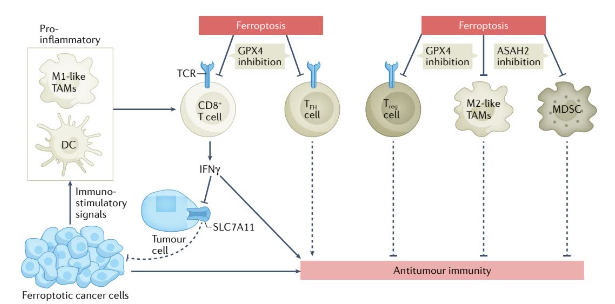
图2. 铁死亡在抗肿瘤免疫的作用
(虚线指示细胞或蛋白质的功能在相应的环境中被减弱或阻断)
(图片来源于《Nat Rev Cancer》)
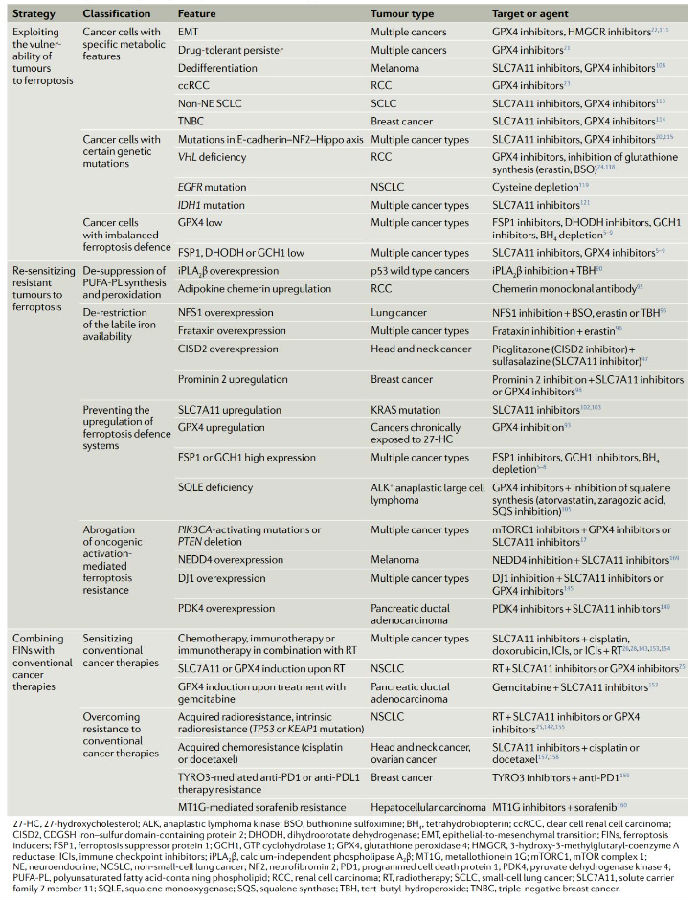
在癌症研究中铁死亡诱导剂具有巨大的治疗潜力。此外,目前开发了多种纳米材料,靶向诱导铁死亡或增强铁死亡诱导剂的活性。越来越多的证据表明,铁死亡诱导剂可以通过促进肿瘤细胞铁死亡来增强传统癌症治疗(放疗、化疗、靶向治疗和免疫治疗)的疗效。可见,用铁死亡诱导剂诱导铁死亡可能是一种极具前景的治疗策略,用于消除具有特定特征的癌症。
表1. 目前癌症治疗中靶向铁死亡的治疗策略
(来源于《Nat Rev Cancer》)
云克隆开发的相关靶标产品助力细胞死亡与癌症关联研究,部分指标节选如下:
指标 | 核心货号 | 指标 | 核心货号 | 指标 | 核心货号 |
GSDMA | GSDMB | GSDMC | |||
GSDMD | Granzyme B | IL1a | |||
IL1b | IL22 | C032 | NLRP3 | ||
| ATP | HMGB1 | A399 | Caspase 1 | ||
| Caspase 3 | PD1 | IFNγ | |||
| SLC7A11 | GPX4 | ASAH2 | |||
| ALK | BH4 | DHODH | |||
FSP1 | GCH1 | HMGCR | |||
iPLA2β | NF2 | PDK4 | |||
| PDK4 | SQLE | SQS |