胰腺癌研究新进展
在过去的几年中,胰腺癌的发病率有所增加,预计将继续成为癌症相关死亡率的主要原因之一。大多数患者在疾病发展到晚期转移时无明显症状,此时肿瘤细胞具有高度侵袭性。胰腺癌早期诊断困难,已成为最致命的恶性肿瘤之一。即使经过潜在的根治治疗,大多数患者最终也会复发,5年生存率仅为2%-9%。近期,多篇文献报道了胰腺癌研究新进展,可能有助于胰腺癌的治疗以改善患者预后。
1. 微生物衍生3-IAA对胰腺癌化疗疗效的影响
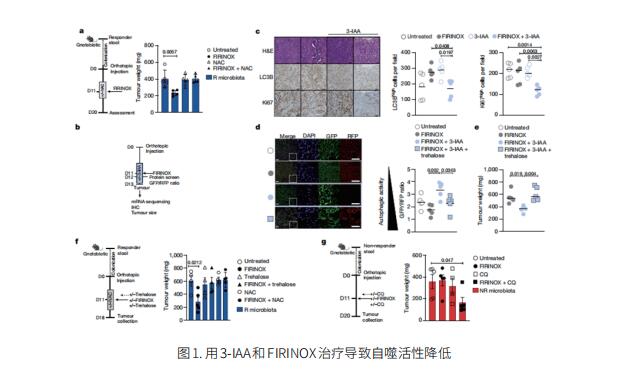
胰腺导管腺癌(PDAC)具有高转移性,不到一半的患者对PDAC的主要治疗方法有反应。饮食是影响治疗反应的环境因素,但其在PDAC中的作用尚不清楚。德国汉堡-埃彭多夫大学医学中心医学部Nicola Gagliani团队使用霰弹枪宏基因组测序和代谢组学筛选,发现微生物群衍生的色氨酸代谢产物吲哚-3-乙酸(3-IAA)在对治疗有反应的患者中富集[1]。粪便微生物群移植、色氨酸的短期饮食和口服3-IAA给药增加了PDAC人源化无菌小鼠模型中化疗的效果。通过结合功能丧失和获得实验,他们表明3-IAA和化疗的有效性是由中性粒细胞衍生的髓过氧化物酶介导的。髓过氧化物酶氧化3-IAA,与化疗联合诱导活性氧(ROS)降解酶谷胱甘肽过氧化物酶3和7的下调。这些都导致癌细胞中ROS的积累和自噬的下调(图1),损害了它们的代谢适应性,并最终影响了它们的增殖。这项研究确定了一种微生物衍生的代谢物,它在PDAC的治疗中具有临床意义,并为癌症患者治疗期间考虑营养干预提供了依据。
2. 胰腺癌抗PD-1新辅助治疗后肿瘤微环境变化的多组学分析
PDAC对免疫疗法不敏感,因为它们缺乏对免疫检查点抑制剂(ICI)有反应的效应T细胞(Teff)的自然浸润。有效的PDAC免疫疗法需要优化和维持激活的Teff。美国约翰斯·霍普金斯大学医学院肿瘤系Lei Zheng团队应用多组学对治疗前和治疗后的PDAC标本进行配对分析,以揭示敏感性和耐药性机制[2]。这些标本来自粒细胞-巨噬细胞集落刺激因子分泌的PDAC疫苗(GVAX)±nivolumab疗法的研究。他们发现GVAX诱导的三级淋巴聚集体成为对GVAX+nivolumab反应的免疫调节位点。GVAX+nivolumab治疗后,肿瘤相关中性粒细胞(TAN)密度较高,预示着总生存期(OS)较差。表达CD137的T细胞增加与细胞毒性Teff特征相关,并与OS增加相关。批量和单细胞RNA测序发现,nivolumab改变CD4+T细胞趋化性信号传导,与CD11b+中性粒细胞脱颗粒有关,CD137的CD8+T细胞表达是T细胞最佳活化所必需的(图2)。这些发现为PDAC中PD-1调节的免疫途径提供了见解,可能为包括TAN调节因子和T细胞激活剂在内的更有效的治疗组合提供信息。

3. 鸟氨酸转氨酶支持胰腺癌中多胺的合成
尽管十多年来靶向肿瘤代谢一直是深入研究的焦点,但肿瘤代谢的可塑性和高毒性风险限制了这种抗癌策略。美国波士顿儿童医院内分泌科Nada Y. Kalaany团队在人类和小鼠的体外和体内模型中使用遗传和药理学方法来表明PDAC对谷氨酰胺从头合成鸟氨酸有明显的依赖性[3]。他们发现,这一过程是通过鸟氨酸氨基转移酶(OAT)介导的,支持多胺的合成,是肿瘤生长所必需的。这种定向OAT活性通常主要局限于婴儿期,与大多数成人正常组织和其他癌症类型依赖精氨酸衍生的鸟氨酸合成多胺形成对比。这种依赖性与PDAC肿瘤微环境中的精氨酸耗竭有关,并由突变KRAS驱动。激活的KRAS诱导OAT和多胺合成酶的表达,导致PDAC肿瘤细胞转录组和开放染色质景观的改变(图3)。PDAC(而非正常组织)对OAT介导的从头合成鸟氨酸的明显依赖性可能是治疗胰腺癌的潜在途径。

4. 剪接因子SRSF1促进胰腺炎和KRASG12D介导的胰腺癌
失调的RNA剪接因子在肿瘤发生中已被广泛报道,但它们在胰腺炎和PDAC中的作用尚不清楚。美国纽约州冷泉港实验室Adrian R. Krainer团队报道剪接因子SRSF1在胰腺炎、PDAC前体病变和肿瘤中高度表达[4]。SRSF1的增加足以诱导胰腺炎并加速KRASG12D介导的PDAC。从机制上讲,SRSF1通过选择性剪接调节mRNA稳定性,部分通过上调白细胞介素1受体1型(IL1R1)来激活MAPK信号传导(图4)。此外,SRSF1蛋白通过负反馈机制在小鼠胰腺中表达KRASG12D的表型正常上皮细胞和急性表达KRASG12D的胰腺类器官中失调,缓冲MAPK信号并维持胰腺细胞稳态。SRSF1的这种负反馈调节被过度活跃的MYC克服,促进PDAC肿瘤的发生。这项研究结果表明SRSF1与胰腺炎和PDAC的病因有关,并指出SRSF1失调的选择性剪接是一个潜在的治疗靶点。

参考文献
[1]Tintelnot J, Xu Y, Lesker TR, et al. Microbiota-derived 3-IAA influences chemotherapy efficacy in pancreatic cancer [J]. Nature. 2023;615(7950):168-174. (IF=69.504)
[2]Li K, Tandurella JA, Gai J, et al. Multi-omic analyses of changes in the tumor microenvironment of pancreatic adenocarcinoma following neoadjuvant treatment with anti-PD-1 therapy [J]. Cancer Cell. 2022;40(11):1374-1391.e7. (IF=38.585)
[3]Lee MS, Dennis C, Naqvi I, et al. Ornithine aminotransferase supports polyamine synthesis in pancreatic cancer [J]. Nature. 2023;616(7956):339-347. (IF=69.504)
[4]Wan L, Lin KT, Rahman MA, et al. Splicing Factor SRSF1 Promotes Pancreatitis and KRASG12D-Mediated Pancreatic Cancer [J]. Cancer Discov. 2023;CD-22-1013. (IF=38.272)
云克隆不仅可提供多种肿瘤实验动物模型,包括肿瘤移植动物模型、自发性肿瘤动物模型、诱发性肿瘤动物模型、肿瘤转移动物模型等,涵盖常见肿瘤研究。还具有各类癌症检测指标及上述IAA、OAT、SRSF1、IL1R1、MAPK、MYC等相关产品,可助力广大科研工作者进行癌症相关研究。
