睡眠机制研究新发现——助力相关疾病治疗
睡眠起源于动物进化的早期,在不同物种之间具有相似的特征。睡眠的数量和质量对健康都很重要,睡眠质量取决于入睡的时间、潜伏期、醒来的频率、持续时间以及睡眠深度。睡眠障碍是一种非常普遍的疾病,它扰乱了正常的昼夜节律,不仅会降低生活质量和工作效率,还会增加医疗和精神病学问题。它被认为是许多疾病的危险因素,包括心血管事件、高血压和2型糖尿病。近期,多篇文献报道了睡眠机制相关研究,可能为相关疾病的预防和治疗提供帮助。
1. 肠道分泌的肽抑制睡眠中的唤醒
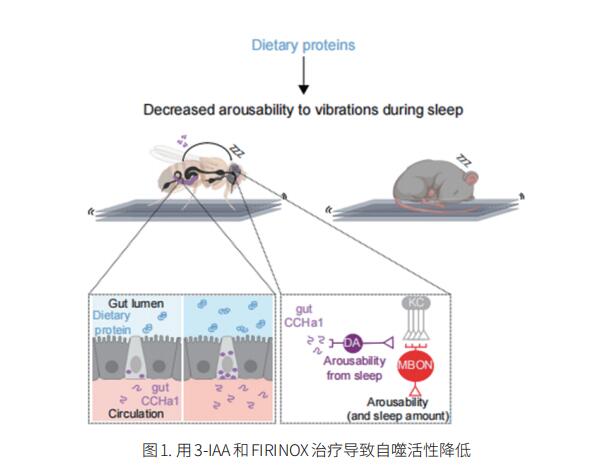
抑制感官唤醒对睡眠至关重要,深度睡眠需要更强的感官抑制。然而,使熟睡的动物在很大程度上忽视周围环境的机制尚不清楚。美国哈佛医学院神经生物系Dragana Rogulja团队发现,当饮食富含蛋白质时,睡眠中的果蝇和小鼠对机械振动的反应会得到更好的抑制[1]。在果蝇中,他们描述了一条信号通路,通过该通路,有关摄入蛋白质的信息从肠道传递到大脑,以帮助抑制唤醒。肠道内较高的蛋白质浓度促进释放CCHa1肽的肠内分泌细胞活性增加。CCHa1向大脑中的一小群多巴胺神经元发出信号,以调节它们的活动;多巴胺能活性调节动物对振动的行为反应(图1)。CCHa1通路和膳食蛋白并不影响对所有感觉输入的反应性,这表明在睡眠期间,不同的信息流可以通过独立的机制进行门控。
2. Cryptochrome-Timeless结构揭示昼夜节律时钟计时机制
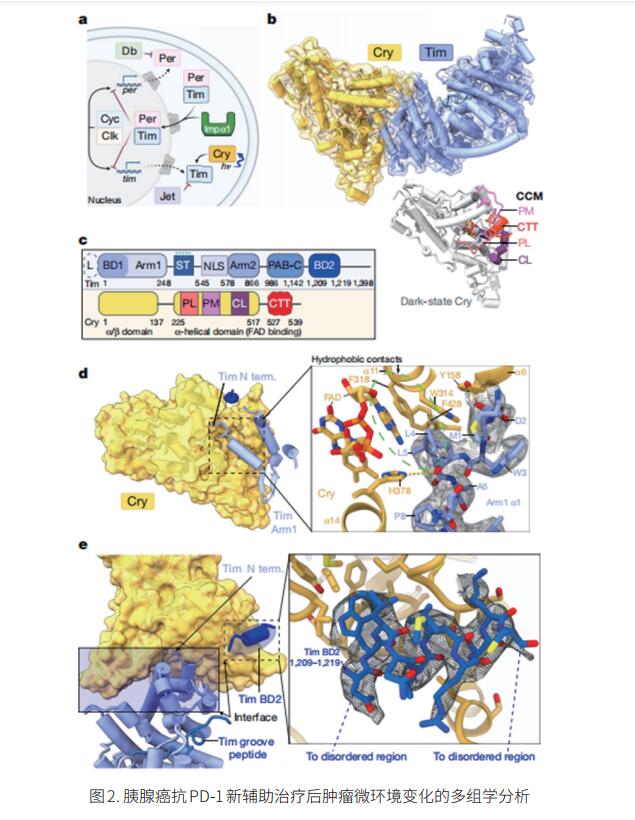
昼夜节律影响许多行为和疾病。果蝇生物钟为研究这些过程提供了一个有价值的模型,其中Timeless(Tim)在介导转录抑制因子Period(Per)入核中发挥关键作用,而光感受器Cryptochrome(Cry)通过触发Tim在光下降解来调节生物钟。美国康奈尔大学化学生物系Brian R. Crane团队使用低温电子显微镜技术,确定了黑腹果蝇的昼夜节律光传感器及其靶标的结构[2]。Cry与氨基酸末端Tim重复序列的连续核心结合,类似于光解酶识别受损DNA的方式,并与C末端Tim螺旋结合(图2)。该结构强调了Cry黄素辅助因子如何发生构象变化,与分子界面的大规模重排相耦合,以及Tim中的磷酸化段如何通过调节Importin-α的结合和Tim-Per的核导入而影响时钟周期。此外,该结构显示,Tim的N端插入重组的Cry口袋,以取代由光释放的自抑制性C端尾巴,从而为长短Tim多态性如何使果蝇适应不同气候提供了可能的解释。
3. 兴奋性神经元中的激酶信号调节睡眠数量和深度
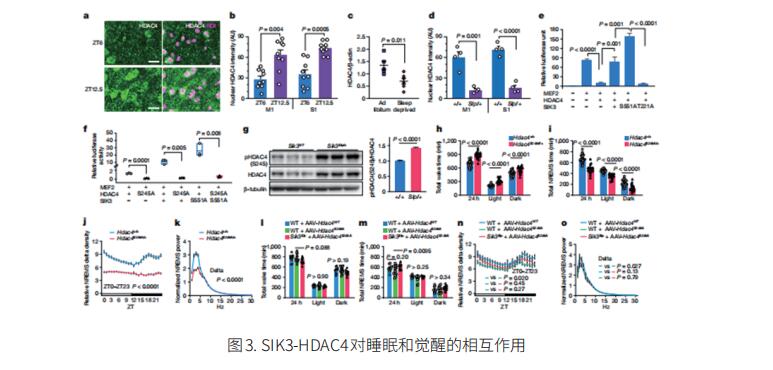
在神经回路水平上阐明睡眠和觉醒调节已经取得了进展。然而,调节睡眠的细胞内信号通路以及这些细胞内机制在哪些神经元群中发挥作用仍不清楚。日本筑波大学国际整合睡眠医学研究所Hiromasa Funato团队使用正向遗传学方法,发现组蛋白脱乙酰酶 4(HDAC4)是一种睡眠调节分子[3]。HDAC4是盐诱导激酶3(SIK3)的底物,其单倍剂量不足可增加睡眠。相比之下,神经元中缺乏SIK3或其上游激酶LKB1的小鼠,或具有对SIK3磷酸化产生耐药性的Hdac4S245A突变的小鼠,其睡眠减少(图3)。这些结果表明,LKB1-SIK3-HDAC4构成了一个调节睡眠和清醒的信号级联。他们还对特定神经元和大脑区域的SIK3和HDAC4进行了靶向操作。结果表明,位于大脑皮层和下丘脑的兴奋性神经元中的SIK3信号分别正向调节非快速眼动睡眠(NREMS)EEGδ功率和NREMS睡眠量。在皮质谷氨酸能神经元中,偏向突触功能的转录物子集通常通过SIK3功能获得等位基因的表达和睡眠剥夺受到调节。这些发现表明,NREMS睡眠的数量和深度由不同的兴奋性神经元群通过共同的细胞内信号调节,为连接细胞内事件和控制NREMS的神经环路水平机制奠定了基础。
参考文献
[1]Titos I, Juginović A, Vaccaro A, et al. A gut-secreted peptide suppresses arousability from sleep [J]. Cell. 2023,186(7):1382-1397.e21. (IF=66.850)
[2]Lin C, Feng S, DeOliveira CC, Crane BR. Cryptochrome-Timeless structure reveals circadian clock timing mechanisms [J]. Nature. 2023,617(7959):194-199. (IF=69.504)
[3]Kim SJ, Hotta-Hirashima N, Asano F, et al. Kinase signalling in excitatory neurons regulates sleep quantity and depth [J]. Nature. 2022,612(7940):512-518. (IF=69.504)
云克隆不仅可提供睡眠剥夺动物模型,还具有包括阿尔兹海默症、帕金森、焦虑症、慢性应激抑郁等常见神经系统疾病动物模型和疾病检测指标相关产品,可助力广大科研工作者进行睡眠相关疾病研究。