铁死亡与心血管疾病的关联
铁死亡是一种由铁依赖性脂质过氧化驱动的新型调节性细胞死亡方式。越来越多的证据表明铁死亡在许多心血管疾病的发生发展过程中起着重要作用。近年来,通过研究心血管疾病的多种模型中铁死亡调控涉及的主要代谢途径(图1)包括铁代谢、谷胱甘肽(GSH)代谢以及脂质代谢,发现调节其代谢途径可调控心肌细胞铁死亡的发生和执行,合理调控可有助于改善心血管疾病,靶向铁死亡代谢途径的调控有可能成为心血管疾病的新的治疗方向。下面从这几个方面看看铁死亡与心血管疾病的关联。
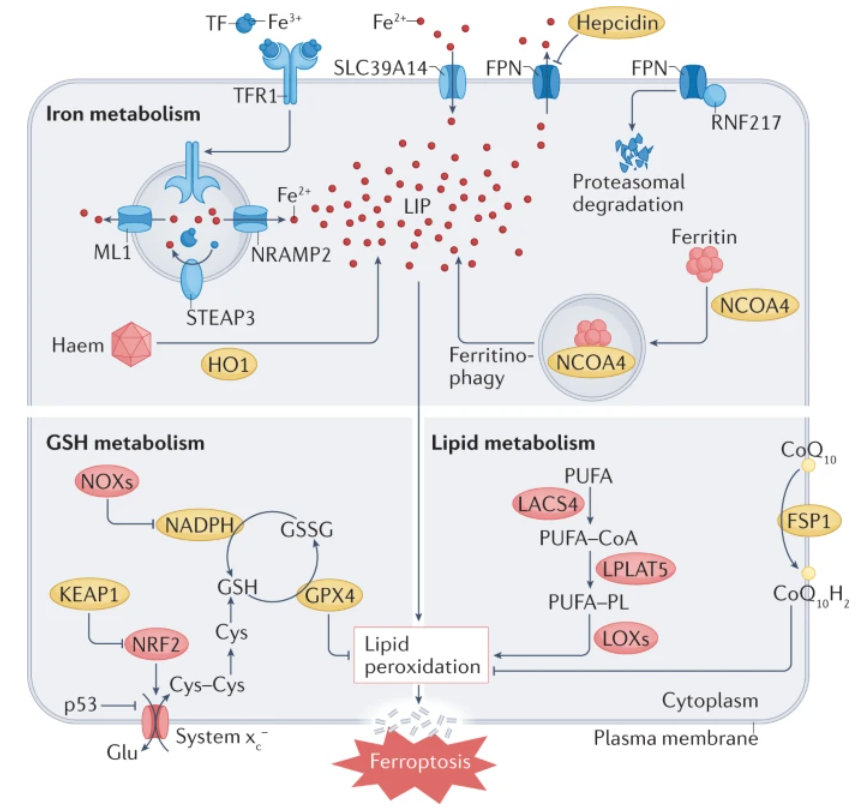
图1. 铁死亡相关代谢通路。
(图片来自《Nature Reviews Cardiology》)
Part 1 铁代谢
铁是一种存在于几乎所有生命形式中的必需微量元素,对细胞的生存至关重要,但铁过载或缺乏都会致病。在人类中,缺铁是最常见的营养不良相关疾病,铁缺乏症是心衰患者的常见合并症。然而原发和继发性的铁过载都会通过氧化损伤导致心脏病,研究发现心肌细胞中铁死亡也受铁代谢途径的调节,该途径涉及铁的吸收、转运、储存和利用。
心肌细胞中通过转铁蛋白受体(TFR1)结合的二铁转铁蛋白(TF)的内吞作用来吸收铁。为了维持细胞质中的铁水平,三价铁可以从内溶酶体中的TF释放,并在前列腺六跨膜表皮抗原3(STEAP3)介导下还原成二价铁,后通过人自然抗性相关巨噬细胞蛋白2(NRAMP2)输出到细胞质。过量的铁要么与重肽铁蛋白(FTH)结合,要么由膜铁转运蛋白(FPN)输出,FPN是脊椎动物细胞中唯一已知的铁转出通道。此外,铁可以通过核受体共激活因子4(NCOA4)介导的铁蛋白自噬降解从FTH释放,这一过程被称为铁蛋白吞噬。铁调素(HEPC)是一种主要在肝脏中合成的肽激素,通过E3泛素蛋白连接酶(RNF217)介导的肠道和脾脏中的泛素化抑制FPN,从而分别调节铁吸收和铁循环。(图2)

图2. 心脏铁代谢调节铁死亡
(图片来自《Nature Reviews Cardiology》)
机体通过铁代谢维持铁稳态,这对于维持正常的心脏功能至关重要。越来越多的证据表明,铁失衡是许多心血管疾病亚型的共同特征。TFR1基因敲除的小鼠会罹患严重的心肌病,伴有心脏缺铁,并在生命的第二周死亡。FTH基因的心脏特异性缺失会导致心脏中的铁失调和氧化应激增加,从而导致铁过载诱导的心脏组织损伤。在早期心肌细胞特异性缺失编码FPN基因的小鼠中观察到心肌细胞铁死亡、心脏功能受损和寿命的缩短。心肌细胞中特异性HEPC的缺失会促使心脏缺铁从而导致致命的心肌病。
Part 2 谷胱甘肽代谢
谷胱甘肽(GSH),具有抗氧化作用,可通过减少氧化应激以促进机体维持正常的心血管功能。在一项基于日本人群的研究中,发现所有心脏病患者的血浆GSH水平均显著低于健康对照组。在随后的一项研究中,无症状和有症状的心脏病患者的血液中GSH水平分别降低了21%和40%。
在正常情况下,GSH作为一种强还原分子,主要用于减少细胞代谢过程中产生的有害脂质氢过氧化物(LOOH)。目前,调节GSH代谢途径的关键在于半胱氨酸(Cys)和谷胱甘肽过氧化酶4(GPX4)。这是因为通过阻断Cys摄取或直接抑制GPX4来抑制GSH合成会导致铁介导的脂质过氧化产物的形成和积累,促进心肌细胞铁死亡。
GSH是由谷氨酸(Glu),半胱氨酸(Cys)和甘氨酸(Gly)组成的三肽。在这些氨基酸中,Cys是GSH合成的限速前体。大多数细胞从谷氨酸/胱氨酸反转运系统XC−(也被称为xCT)摄取细胞外Cys,该系统由溶质载体家族3成员2(SLC3A2)和溶质载体家族7成员11(SLC7A11)组成。 xCT以 1:1 的比例转出细胞内Glu和转入细胞外胱氨酸(Cys-Cys);然后通过消耗NADPH的还原反应将新导入胞质溶胶中的Cys-Cys转化为Cys。在心肌细胞中选择性过表达SLC7A11会增加细胞GSH水平并防止心脏铁死亡,这首次证明了SLC7A11在心脏中具有抗铁死亡作用。此外,敲除SLC7A11会加重小鼠的心脏肥大和功能障碍,这两种情况都可以通过抑制铁死亡来逆转。
尽管缺乏直接证据表明铁死亡与人类心脏病有关,但在铁死亡代谢中相关基因(如SLC7A11和GPX4)改造的心肌细胞特异性动物疾病模型中,关于铁死亡诱导剂或抑制剂的研究提供了令人信服的前临床证据,证明GSH代谢对心脏铁死亡具有保护作用。
Part 3 脂质代谢
由于心脏对能量的需求非常高,特别容易受到氧化损伤,脂质过氧化是ROS诱导的心脏损伤的重要原因。心脏组织具有几种内源性ROS的潜在来源,包括线粒体电子传递链(ETC)、NADPH氧化酶(NOX)、黄嘌呤氧化还原酶(XDH)、一氧化氮合酶(NOS)和细胞色素P450(CYP450)。此外,一些外源性因素和化学物质会导致氧化损伤。源自含有PUFA的膜磷脂氧化的脂质过氧化物的积累表明,抗氧化系统不能总是有效地平衡ROS的产生。脂质过氧化是心脏氧化应激最明显的表现之一。亲电反应性醛,如丙二醛(MDA)、4-羟基己烯醛和4-羟基壬烯醛,是PUFA氧化的主要终产物,常用作脂质过氧化的标记物。在一项为期一年的随访研究中,发现血清MDA水平高是慢性心力衰竭患者死亡的独立预测因素和综合临床终点。这些结果与之前的研究结果一致,并支持脂质过氧化在心脏病的发展和严重程度中都有作用的假设。值得注意的是,脂质过氧化通过破坏细胞膜来驱动细胞铁死亡。脂质过氧化物的清除可以保护心肌细胞免受脂质过氧化诱导的膜结构损伤,并抑制铁死亡。
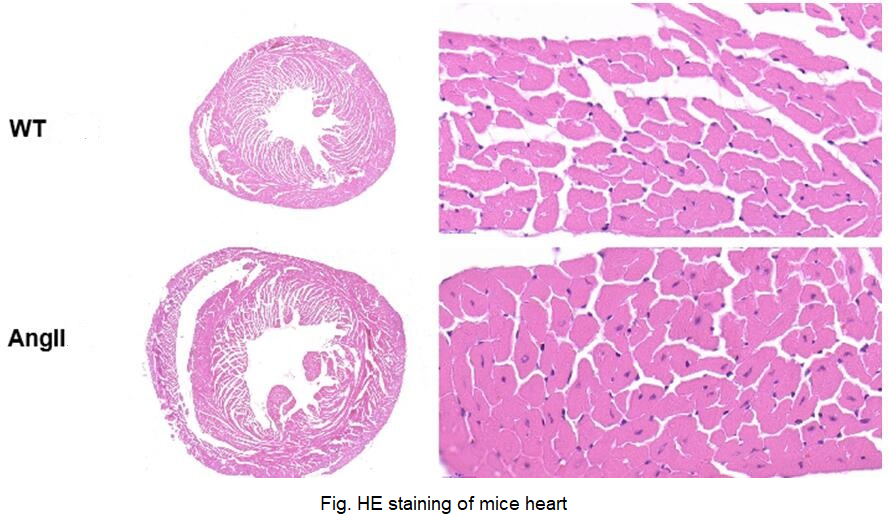
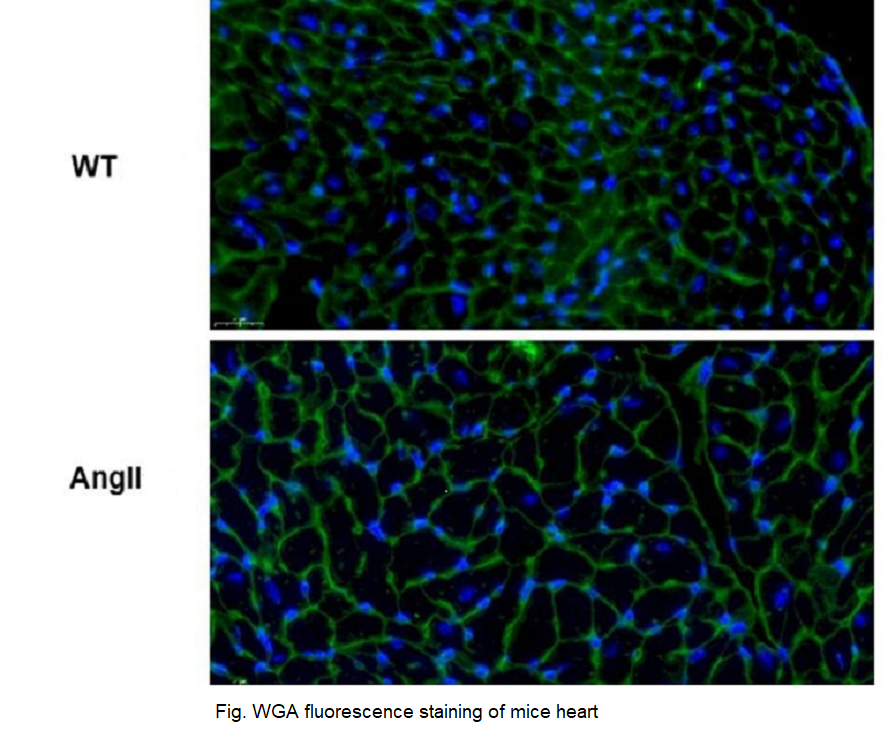
云克隆可提供上述研究中涉及到的心肌肥厚(CH)动物模型。
模型展示
心肌肥厚(CH)大鼠模型
心肌肥厚(CH)小鼠模型
云克隆还开发了上述研究中涉及到的相关靶标产品的蛋白、抗体以及试剂盒产品。靶标及核心货号如下,供参考。
指标名 | 核心货号 | 指标名 | 核心货号 | 指标名 | 核心货号 |
GSH | TFR1 | TF | |||
NRAMP2 | FTH | FPN | |||
HEPC | Cys | GPX4 | |||
Glu | Gly | SLC3A2 | |||
SLC7A11 | XDH | MDA | |||
NOX1 | NOX2 | NOX3 | |||
NOX4 | NOX5 | NOS1 | |||
NOS2 | NOS3 |