长时间睡眠不足会诱发哺乳动物细胞因子风暴样综合征
睡眠对于绝大多数动物来说都是不可或缺的,睡眠不足会导致严重的生理和病理后果,甚至死亡。早在2007年,国际癌症研究机构(IARC)就把熬夜和昼夜节律打乱的行为定义为2A类致癌物。然而,目前关于睡眠调节免疫力的内在机制以及睡眠不足对健康的不良影响机制尚未得以阐明。不久前,来自清华大学生物医学研究院的团队在《Cell》上发表了题为“Prolonged sleep deprivation induces a cytokine-storm-like syndrome in mammals”的文章。他们研发出的“水箱睡眠剥夺“模式,使小鼠能在96%的时间内保持清醒。研究发现,睡眠剥夺增加了大脑中前列腺素D2(PGD2)的水平,由ATP结合盒亚家族C4转运蛋白(ABCC4)介导的PGD2穿过血脑屏障(BBB)的流出量升高会诱导循环中性粒细胞的积累和细胞因子风暴样综合征。而PGD2/DP1轴的实验性破坏能显著减少睡眠剥夺引起的炎症。这项研究揭示了中枢神经系统中PGD2与睡眠相关的变化会对周围免疫系统产生深远的病理影响。
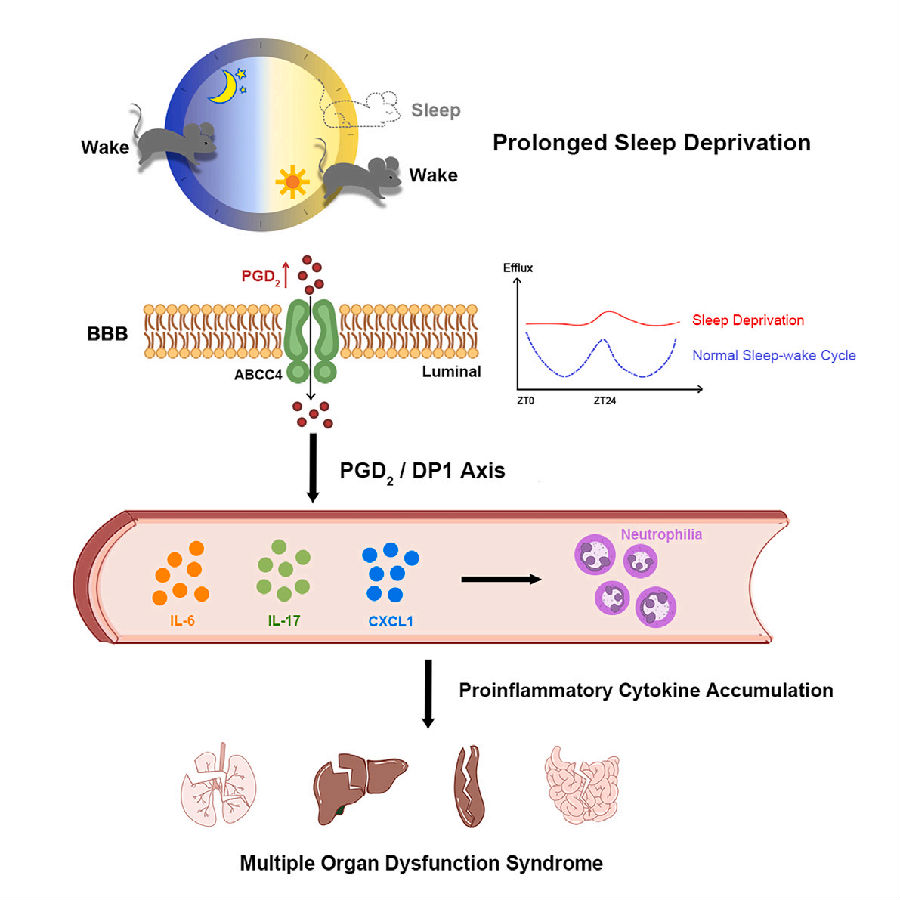
图1. 概要图
(图片源自《Cell》)
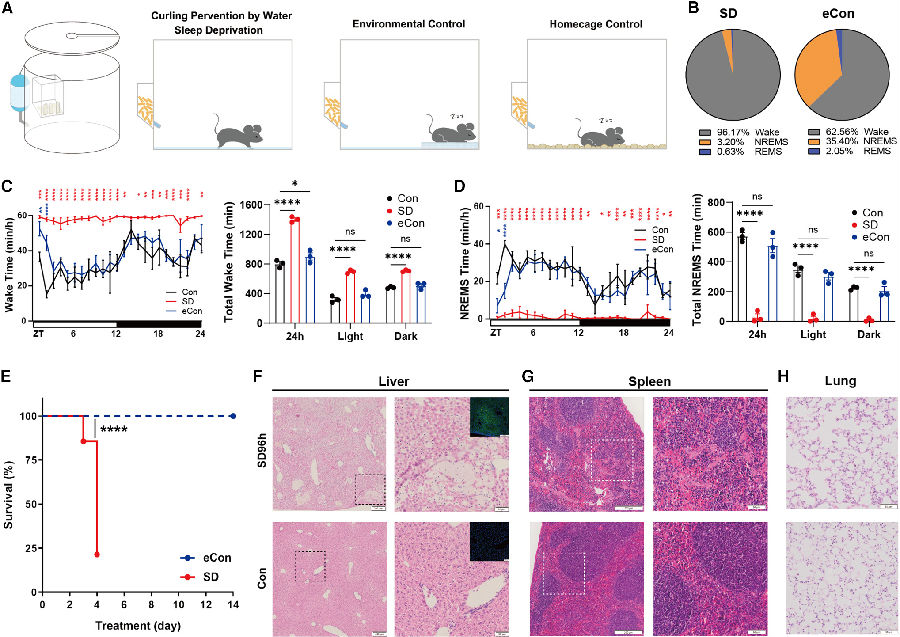
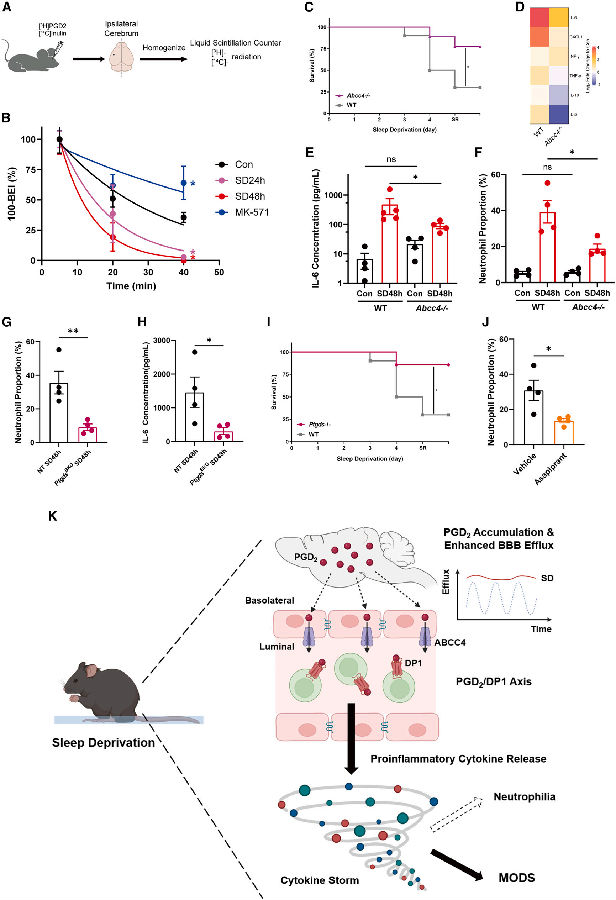
首先,研究者建立了一种新的小鼠睡眠剥夺(SD)系统,命名为CPW模式。该模式可持续剥夺小鼠96%以上的睡眠。为了检验延长SD的生理后果,作者将成年小鼠置于CPW模式下。在短短4天的时间内,80%的SD小鼠经历了在SD开始后72h-96h过早死亡。SD小鼠病理检查显示多系统脏器损伤,包括肝脏、脾脏、肺、肠和肾。总的来说,这些发现揭示了长期的SD会导致危及生命的多器官功能障碍综合症(MODS)。
图2. 长时间的睡眠剥夺会导致小鼠全身炎症和过早死亡
(图片源自《Cell》)
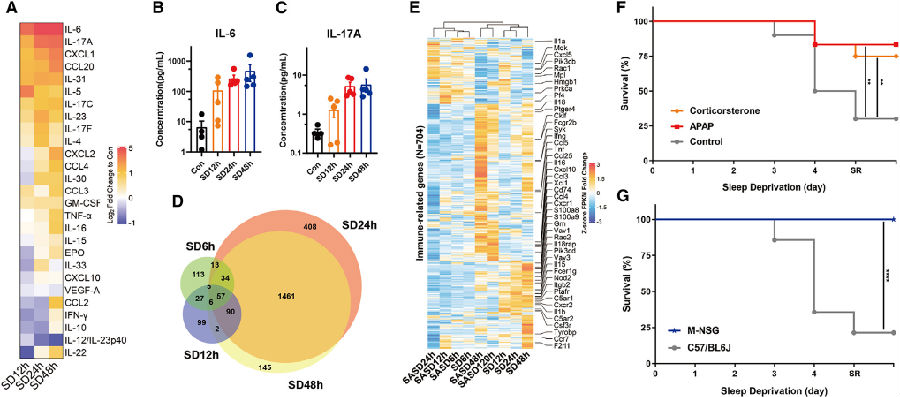
在人类中,细胞因子风暴的特征是促炎细胞因子的过度释放,并可导致器官损伤、发病率和死亡率升高。由于SD小鼠表现出器官损伤和炎症特征,研究者推测它们可能遭受了细胞因子风暴的病理后果。为了研究这一动态,他们检测了SD后小鼠血清中27种促炎细胞因子和趋化因子的水平,结果表明,随着时间推移,大多数促炎因子上调。值得注意的是,IL-6和IL-17A是SD诱导变化最显著的促炎细胞因子,而这两种因子恰好也是介导人类细胞因子风暴的主要炎症因子。为了研究SD诱导细胞因子产生的机制,研究者在SD过程中对小鼠血液白细胞进行了RNA测序分析,转录组比较分析表明,细胞因子的产生随着SD的进展而增强,并且不同亚型的白细胞对SD表现出不同的反应。结合MODS表型,这些结果表明SD在小鼠中引发了细胞因子风暴样综合征。研究者进一步比较了细胞因子在SD诱导死亡中的作用,SD小鼠给予抗细胞因子风暴剂,用这些药物治疗的小鼠对SD诱导的死亡产生明显抗性。对免疫缺陷小鼠的研究也表明,这些小鼠在SD 96h后都存活下来。总之,这些发现表明,SD诱导的死亡可以通过抑制促炎细胞因子信号通路来预防。
图3. 睡眠剥夺会诱发血液中促炎细胞因子的积累
(图片源自《Cell》)
由于测序数据显示,中性粒细胞相关基因在SD 24h后上调,研究者接下来对对照组、SD 24h和SD 48h小鼠进行了单细胞RNA测序分析,以探究SD诱导的白细胞亚群的变化。结果显示中性粒细胞和单核细胞的比例在SD 24h上调,而淋巴细胞的比例则相反。这与前面RNA测序的结果一致。对中性粒细胞在SD 24h和SD 48h上调的基因进行GO分析发现,中性粒细胞脱颗粒、中性粒细胞和细胞因子介导的免疫信号通路等的富集。这些结果表明,SD期间循环中性粒细胞积聚并被激活,可能是由细胞因子信号通路介导的。为了评估循环中性粒细胞对SD诱导死亡的贡献,研究者通过腹腔内注射抗Ly6G抗体来耗尽中性粒细胞。与同型对照相比,中性粒细胞耗竭的小鼠确实表现出对SD诱导的死亡的抵抗力。
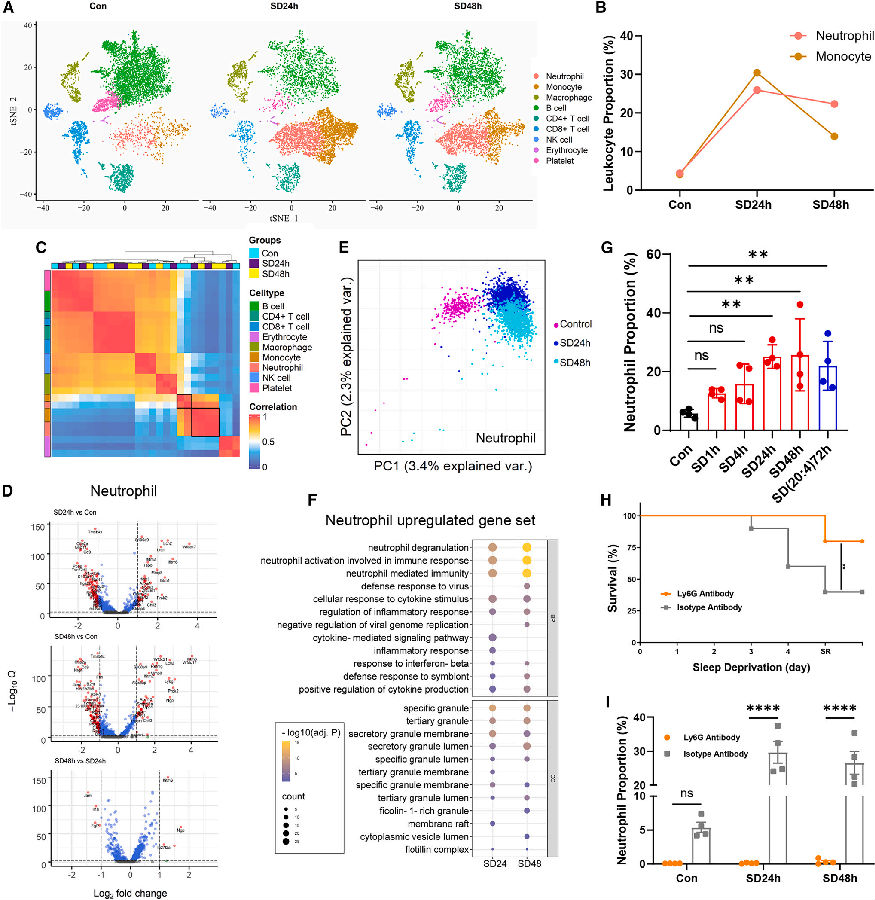
(图片源自《Cell》)
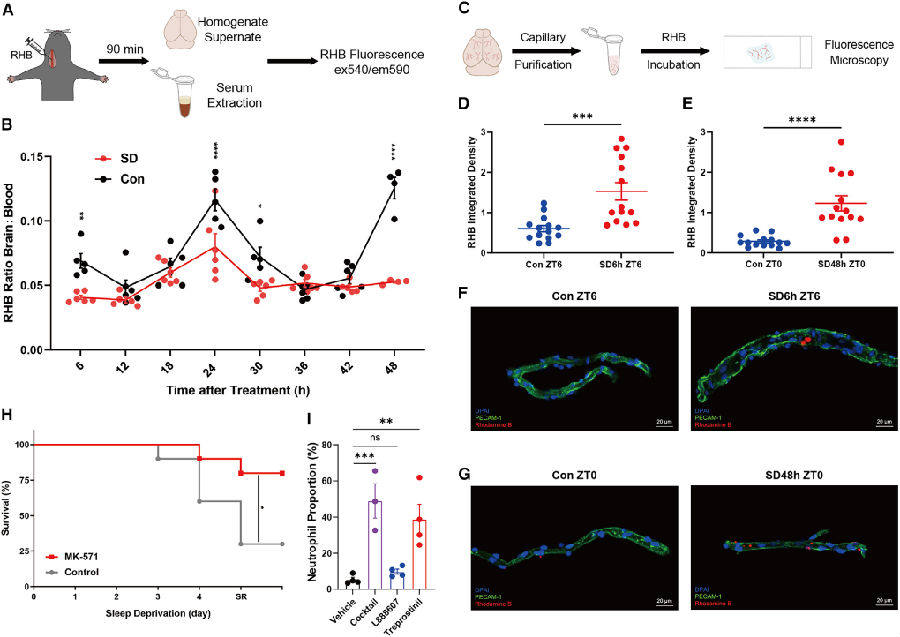
接下来,作者探究了SD诱导的免疫反应是否需要跨BBB的转运。使用普通ABC转运蛋白底物罗丹明 B(RHB)进行了体内外排实验,以评估BBB内皮细胞中ABC转运蛋白的活性。结果表明,SD小鼠的昼夜节律振荡明显减弱,外排增强。此外,通过体外ABC转运蛋白流出实验也同样观察到此现象,说明大脑影响SD诱导的免疫反应不是通过交感神经系统,而是通过ABC转运蛋白介导的BBB外排。
图5. 睡眠剥夺期间由ABCC转运体经由血脑屏障的外排增强引起全身炎症
(图片源自《Cell》)
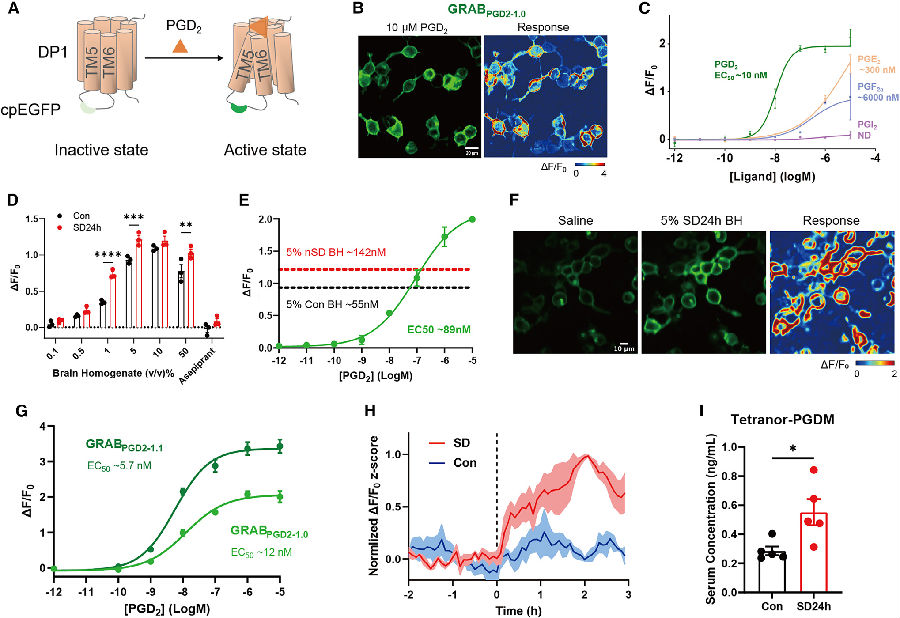
由于PGD2是最有效的内源性睡眠促进物质之一,脑源性GPD2主要由脂钙蛋白型PGD合成酶(PTGDS或L-PGDS)产生。随后,作者通过静脉注射G蛋白偶联受体DP1和DP2激动剂来模拟血液中PGD2水平的增加,以验证脑源性PGD2是否会引发SD诱导的免疫反应。结果发现DP1激动剂导致静息小鼠血液中中性粒细胞的比例呈剂量依赖性增加。表明PGD2在SD期间介导的免疫反应中起了作用。通过基于GPCR激活的(GRAB)传感器监测SD期间大脑中的PGD2水平,发现该荧光传感器对PGD2有特异性响应。且SD 24h小鼠大脑中PGD2的水平和对照组相比升高了158%,表明SD升高了大脑中PGD2的水平。
图6. 睡眠剥夺期间大脑中PGD2水平增加
(图片源自《Cell》)
为了研究PGD2外排是否随着SD的增加而增加,作者采用脑外排指数(BEI)进行测定。结果表明,SD 24h、SD 48h和对照小鼠在SD期间的PGD2通过BBB的外排显著增加。且脑源性PGD2的外排在Abcc4-/-小鼠中被阻断,从而防止SD诱导的死亡。与WT对照组相比,SD 48h处理的Abcc4-/-小鼠的循环促炎症细胞因子,特别是IL-6和循环中性粒细胞水平也有所降低。对PDG合成酶的敲除实验表明,与非靶向(NT)对照小鼠相比,SD 48h时PtgdsBKO(脑嵌合KO)小鼠的循环中性粒细胞和血清IL-6诱导减弱。此外,遗传Ptgds-/-(传统KO)小鼠对SD诱导的死亡具有抗性。综上所述,这些结果揭示了睡眠调节免疫系统的有效途径。SD增强PGD2的BBB外排,从而引发全身性炎症。
图7. 睡眠不足会增加大脑中PGD2的分泌且长时间睡眠不足会引发细胞因子风暴
(图片源自《Cell》)
这一研究发现表明,从药理学角度阻断PGD2/DP1轴能有效降低SD诱导的炎症反应。这为破解睡眠对健康影响相关的药物开发奠定了基础。
云克隆开发了上述研究中相关指标产品以助力科学研究,部分指标如下,供您参考: